题目内容
8.下列实验方案不能达到预期目的是( )| A. | 用Na、Mg分别与冷水反应来证明Na、Mg的金属性强弱 | |
| B. | 用同物质的量浓度的H2SO3酸性比H2CO3强,证明S的非金属性比C强 | |
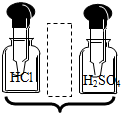
| C. | 用HCl和HBr形成的难易程度,证明Cl的非金属性比Br强 | |
| D. | 用Cu、Mg分别与盐酸反应来证明Cu、Mg的金属性强弱 |
分析 A.金属的金属性越强,其单质与水或酸反应越剧烈;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强(O、F元素除外),强酸能和弱酸盐反应生成弱酸;
C.元素的非金属性越强,其单质与氢气反应越容易;
D.金属的金属性越强,其单质与水或酸反应越剧烈.
解答 解:A.金属的金属性越强,其单质与水或酸反应越剧烈,Na和冷水剧烈反应生成NaOH和氢气、Mg和冷水不反应,所以该实验可以比较Na、Mg的金属性强弱,故A不选;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强(O、F元素除外),强酸能和弱酸盐反应生成弱酸,亚硫酸不是S元素的最高价含氧酸,所以不能根据亚硫酸和碳酸酸性强弱判断非金属性强弱,故B选;
C.元素的非金属性越强,其单质与氢气反应越容易,所以可以根据用HCl和HBr形成的难易程度,证明Cl的非金属性比Br强,故C不选;
D.金属的金属性越强,其单质与水或酸反应越剧烈,Mg和稀盐酸反应生成氢气、Cu和稀盐酸不反应,所以该实验可以比较金属性强弱,故D不选;
故选B.
点评 本题考查化学实验方案评价,为高频考点,侧重考查学生分析判断及总结归纳能力,明确实验原理及物质性质是解本题关键,知道非金属性、金属性强弱比较方法,易错选项是B.

练习册系列答案
相关题目
18.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸在一定的条件下反应制得.

下列有关说法不正确的是( )

下列有关说法不正确的是( )
| A. | 该反应是加成反应 | |
| B. | 1 mol羟基扁桃酸能与3mol NaOH反应 | |
| C. | 乙醛酸与H2加成的产物能在催化剂作用下形成高分子化合物 | |
| D. | 苯酚和羟基扁桃酸遇上FeCl3溶液都会显色 |
19.化学与社会、科学、技术、环境等有密切关系.下列说法不正确的是( )
| A. | 司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金 | |
| B. | 氯气是塑料、合成橡胶、合成纤维、农药、染料及药品的重要原料 | |
| C. | 工业上生产玻璃、水泥、漂白粉均需要用石灰石为原料 | |
| D. | 用浸泡过溴的四氯化碳溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的 |
16.近年来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
①结合上表数据,写出NO与活性炭反应的化学方程式C+2NO?N2+CO2;
②上述反应的平衡常数表达式K=$\frac{c({N}_{2})c(C{O}_{2})}{{c}^{2}(NO)}$,根据上述信息判断,T1和T2的关系是C;
A.T1>T2B.T1<T2C.无法比较
③在T1℃下反应达到平衡后,下列措施能改变NO的转化率的是cd;
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2,具体流程如图1所示

①用离子方程式表示反应器中发生的反应SO2+I2+2H2O=SO42-+2I-+4H+;
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行;
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示
通过a气体的电极是原电池的负极(填“正”或“负”),b电极反应式为O2+4e-+4H+=2H2O.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
 | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应的平衡常数表达式K=$\frac{c({N}_{2})c(C{O}_{2})}{{c}^{2}(NO)}$,根据上述信息判断,T1和T2的关系是C;
A.T1>T2B.T1<T2C.无法比较
③在T1℃下反应达到平衡后,下列措施能改变NO的转化率的是cd;
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2,具体流程如图1所示

①用离子方程式表示反应器中发生的反应SO2+I2+2H2O=SO42-+2I-+4H+;
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行;
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示
通过a气体的电极是原电池的负极(填“正”或“负”),b电极反应式为O2+4e-+4H+=2H2O.
13.20mL0.05mol/L含有Cr2O72-离子的浓溶液恰好能将20mL0.3mol/L的Fe2+溶液完全氧化,则元素Cr在还原产物中的化合价为( )
| A. | +3价 | B. | +6价 | C. | +4价 | D. | +5价 |
20.在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.20mol/L,c(Mg2+)=0.50mol/L,c(Cl-)=0.20mol/L,则c(SO42-)为( )
| A. | 0.15mol/L | B. | 0.10mol/L | C. | 0.50mol/L | D. | 0.20mol/L |
18.已知五种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
| A. | L与Q形成的化合物化学式为LQ | |
| B. | L、M的单质与稀盐酸反应剧烈程度:M>L | |
| C. | Q、T的氢化物在常温常压下均为无色气体 | |
| D. | M的最高价氧化物的水化物不具有两性 |