题目内容
 常见元素A、B、C、D,其原子结构的相关信息如下表:
常见元素A、B、C、D,其原子结构的相关信息如下表:| 元素 | 相关信息 |
| A | 核外电子总数等于该基态原子电子层数 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 基态原子L电子层中有3个未成对电子 |
| D | 生活中大量使用的合金制品,工业上可用电解其氧化物的方法制取其单质 |
| E | 外围电子排布为(n+1)d3n(n+2)sn |
(1)按电子排布,可把周期表里的元素划分成5个区,E元素属
(2)ABC分子的空间构型
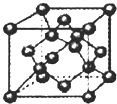
(3)如图所示,为B单质晶体的一种晶胞,密度为d g?cm-3,阿伏伽德罗常数的值为NA,则该晶胞的边长为
(4)已知C2A4和过氧化氢混合可作火箭推进剂.液态C2A4与足量液态过氧化氢反应生成C的单质和气态水,转移1.6mol电子时放出256.0kJ的热量.已知:H2O(l)=H2O(g)△H=+44.0kJ﹒mol-1 写出液态C2A4和足量液态过氧化氢反应生成C的单质和液态水的热化学方程式:
(5)标准状况下,C的某种氧化物(原子个数比为1:1)40L与15L氧气混合通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐,请写出该反应的离子方程式
(6)D的单质与E的红色氧化物在高温条件下反应的方程式为
考点:晶胞的计算,位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A原子的核外电子总数等于其基态电子层数,则A为H元素;B原子的最外层电子数是次外层电子数的2倍,则B原子核外有2个电子层,最外层电子数为4,则B为碳元素;C的基态原子L电子层中有3个未成对电子,则C原子核外电子排布式为1s22s22p3,则C为N元素;D是生活中大量使用的合金制品,工业上可用电解其氧化物的方法制取其单质,所以D为Al元素;E的外围电子层排布为(n+1)d3n(n+2)sn,含有d能级,则电子层最少为3,s能级最多容纳2个电子,则n=2,故E外围电子层排布为3d64s2,则E为Fe,据此解答.
解答:
解:A原子的核外电子总数等于其基态电子层数,则A为H元素;B原子的最外层电子数是次外层电子数的2倍,则B原子核外有2个电子层,最外层电子数为4,则B为碳元素;C的基态原子L电子层中有3个未成对电子,则C原子核外电子排布式为1s22s22p3,则C为N元素;D是生活中大量使用的合金制品,工业上可用电解其氧化物的方法制取其单质,所以D为Al元素;E的外围电子层排布为(n+1)d3n(n+2)sn,含有d能级,则电子层最少为3,s能级最多容纳2个电子,则n=2,故E外围电子层排布为3d64s2,则E为Fe,
(1)E为Fe元素,在周期表中位于ds区,B为碳元素,其原子基态原子的价电子排布图为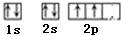 ,故答案为:ds;
,故答案为:ds; ;
;
(2)ABC分子是HCN,由于其中有碳氮三键和碳氢单键,所以其空间构型为直线型,C2A4分子为N2H4,其中有一个氮氮单键,四个氮氢键,每个氮原子有一对孤电子对,所以氮原子的杂化方式为sp3,
故答案为:直线型;sp3;
(3)B为碳元素,在晶胞中含有碳原子数为4+8×
+6×
=8,则晶胞的体积V=
=
cm3=
cm3,所以晶胞的边长为
cm,故答案为:
;
(4)C2A4为肼,足量液态过氧化氢反应生成C的单质和气态水,肼中的氮由-2价到0,所以1mol肼完全反应转移电子数4NA,转移1.6mol电子时放出256.0kJ的热量,则1mol肼完全反应放出641.63KJ,热化学方程式为①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63KJ/mol;结合②H2O(l)=H2O(g)△H=+44.0kJ﹒mol-1,依据盖斯定律①+②×4可以写出生成液态水的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.63KJ/mol,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.63KJ/mol;
(5)C的某种氧化物(原子个数比为1:1)为NO,与氧气反应按40:15=8:3反应,根据氧化还原反应中的电子守恒以及电荷守恒可以写出离子反应方程式:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O,
故答案为:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O;
(6)D的单质为铝与E的红色氧化物三氧化二铁在高温条件下发生铝热反应的方程式为2Al+Fe2O3
Al2O3+2Fe,故答案为:2Al+Fe2O3
Al2O3+2Fe;
(1)E为Fe元素,在周期表中位于ds区,B为碳元素,其原子基态原子的价电子排布图为
 ,故答案为:ds;
,故答案为:ds; ;
;(2)ABC分子是HCN,由于其中有碳氮三键和碳氢单键,所以其空间构型为直线型,C2A4分子为N2H4,其中有一个氮氮单键,四个氮氢键,每个氮原子有一对孤电子对,所以氮原子的杂化方式为sp3,
故答案为:直线型;sp3;
(3)B为碳元素,在晶胞中含有碳原子数为4+8×
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| ρ |
| ||
| d |
| 96 |
| dNA |
| 3 |
| ||
| 3 |
| ||
(4)C2A4为肼,足量液态过氧化氢反应生成C的单质和气态水,肼中的氮由-2价到0,所以1mol肼完全反应转移电子数4NA,转移1.6mol电子时放出256.0kJ的热量,则1mol肼完全反应放出641.63KJ,热化学方程式为①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63KJ/mol;结合②H2O(l)=H2O(g)△H=+44.0kJ﹒mol-1,依据盖斯定律①+②×4可以写出生成液态水的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.63KJ/mol,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.63KJ/mol;
(5)C的某种氧化物(原子个数比为1:1)为NO,与氧气反应按40:15=8:3反应,根据氧化还原反应中的电子守恒以及电荷守恒可以写出离子反应方程式:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O,
故答案为:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O;
(6)D的单质为铝与E的红色氧化物三氧化二铁在高温条件下发生铝热反应的方程式为2Al+Fe2O3
| ||
| ||
点评:本题与元素推断为载体,考查核外电子排布规律、常用化学用语、杂化理论、晶胞结构、热化学方程式、氧化还原反应等,题目综合性较大,综合考查知识迁移运用能力,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列叙述正确的是( )
| A、由同种元素组成的物质肯定属于纯净物 |
| B、含金属元素的离子一定都是阳离子 |
| C、一种元素可能形成多种离子 |
| D、具有相同质子数的粒子都属于同种元素 |
 下图为相互串联的甲乙两个电解池,试回答:
下图为相互串联的甲乙两个电解池,试回答: