题目内容
表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
(1)⑦的氧化物的一种用途 .
(2)表中最活泼的金属是 ,非金属性最强的元素是 ;(填写元素符号);
(3)④⑤⑥的原子半径由小到大的顺序为(用元素符号表示) .②③⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示) .
(4)写出由以上①④⑤元素构成的化合物的电子式 ;该化合物含有的化学键类型有 .
 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑨ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)表中最活泼的金属是
(3)④⑤⑥的原子半径由小到大的顺序为(用元素符号表示)
(4)写出由以上①④⑤元素构成的化合物的电子式
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl、⑨为F.
(1)⑦的氧化物是二氧化硅;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大;同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,最高价含氧酸的酸性越强;
(4)①④⑤元素构成的化合物NaOH,由钠离子与氢氧根离子构成,含有离子键、共价键.
(1)⑦的氧化物是二氧化硅;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大;同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,最高价含氧酸的酸性越强;
(4)①④⑤元素构成的化合物NaOH,由钠离子与氢氧根离子构成,含有离子键、共价键.
解答:
解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl、⑨为F.
(1)⑦的氧化物是二氧化硅,可以由于生产光导纤维(制坩埚、玻璃、陶瓷等),
故答案为:生产光导纤维(制坩埚、玻璃、陶瓷等);
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中Na的金属性最强,F的非金属性最强,故答案为:Na;F;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:O<Al<Na;
同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性Si<C<N,非金属性越强,最高价含氧酸的酸性越强,故酸性:H2SiO3<H2CO3<HNO3 ,
故答案为:O<Al<Na;H2SiO3<H2CO3<HNO3 ;
(4)①④⑤元素构成的化合物NaOH,由钠离子与氢氧根离子构成,电子式为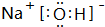 ,含有离子键、共价键,故答案为:
,含有离子键、共价键,故答案为: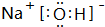 ;离子键、共价键.
;离子键、共价键.
(1)⑦的氧化物是二氧化硅,可以由于生产光导纤维(制坩埚、玻璃、陶瓷等),
故答案为:生产光导纤维(制坩埚、玻璃、陶瓷等);
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中Na的金属性最强,F的非金属性最强,故答案为:Na;F;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:O<Al<Na;
同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性Si<C<N,非金属性越强,最高价含氧酸的酸性越强,故酸性:H2SiO3<H2CO3<HNO3 ,
故答案为:O<Al<Na;H2SiO3<H2CO3<HNO3 ;
(4)①④⑤元素构成的化合物NaOH,由钠离子与氢氧根离子构成,电子式为
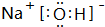 ,含有离子键、共价键,故答案为:
,含有离子键、共价键,故答案为: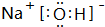 ;离子键、共价键.
;离子键、共价键.
点评:本题考查元素周期表与元素周期律的综合应用,难度不大,注意对元素周期律的理解掌握.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
下列有关叙述中正确的是( )
| A、难溶于水的电解质一定是弱电解质 |
| B、强电解质在水溶液中的电离过程是不可逆的 |
| C、易溶于水的电解质一定是强电解质 |
| D、强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强 |
有关①100ml 0.1mol/L NaHCO3、②100ml 0.1mol/L Na2CO3两种溶液的叙述不正确的是( )
| A、①溶液中:c(CO32-)>c(H2CO3) |
| B、溶液中阴离子的物质的量浓度之和:②>① |
| C、溶液中水电离出的H+个数:②>① |
| D、②溶液中:c(HCO3-)>c(H2CO3) |
通过下列变化,均无法得到单质的是( )
①分解反应
②化合反应
③置换反应
④复分解反应.
①分解反应
②化合反应
③置换反应
④复分解反应.
| A、①② | B、②③ | C、③④ | D、②④ |
 常见元素A、B、C、D,其原子结构的相关信息如下表:
常见元素A、B、C、D,其原子结构的相关信息如下表: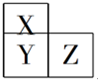 X、Y、Z、T、V为5种短周期元素,X、Y、Z在周期表中位置如图所示,这三种元素原子序数之和是41,X和T在不同条件下反应,可以生成化合物T2X(白色固体)和T2X2(淡黄色固体)两种化合物,V单质在Z单质中燃烧产生苍白色火焰,产物溶于水能使石蕊试液变红,则:
X、Y、Z、T、V为5种短周期元素,X、Y、Z在周期表中位置如图所示,这三种元素原子序数之和是41,X和T在不同条件下反应,可以生成化合物T2X(白色固体)和T2X2(淡黄色固体)两种化合物,V单质在Z单质中燃烧产生苍白色火焰,产物溶于水能使石蕊试液变红,则: (1)肼(N2H4)-空气燃料电池是一种新型环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时:
(1)肼(N2H4)-空气燃料电池是一种新型环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时: