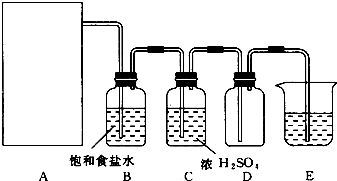
题目内容
13.X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,核电荷数按照Y、Z、X、W的顺序增大.已知Y与Z原子次外层的电子数均为2,W、X原子次外层的电子数为8.(1)写出各元素的名称:X钠,Y碳,Z氮,W氯.
(2)画出X、Y的原子结构示意图:X
 ,Y
,Y .
.(3)写出Z、W在元素周期表中的位置:Z第三周期第VA族,W第三周期第ⅦA族.
(4)写出X的最高价氧化物与Z的最高价氧化物对应水化物反应的化学方程式Na2O+2HNO3═2NaNO3+H2O.
(5)按碱性减弱、酸性增强的顺序排出各元素最高价氧化物对应水化物的分子式:NaOH、H2CO3、HNO3、HClO4.
分析 X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,则X、Y、Z、W分别位于第ⅠA族、ⅣA族、ⅤA族、ⅦA族;核电荷数按照Y、Z、X、W的顺序增大,由于Y与Z的原子次外层的电子数为2,说明Y、Z含有两个电子层,则Y为C元素、Z为N元素;W、X原子次外层电子数为8,则W为Cl元素、X为Na元素,以此解答该题.
解答 解:X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,则X、Y、Z、W分别位于第ⅠA族、ⅣA族、ⅤA族、ⅦA族;核电荷数按照Y、Z、X、W的顺序增大,由于Y与Z的原子次外层的电子数为2,说明Y、Z含有两个电子层,则Y为C元素、Z为N元素;W、X原子次外层电子数为8,则W为Cl元素、X为Na元素.
(1)由上述分析可知,X为钠,Y为碳,Z为氮,W为氯,故答案为:钠;碳;氮;氯;
(2)X为Na元素,质子数为11,核外电子数为11,有3个电子层,最外层1个电子,原子结构示意图为: ,Y为C元素,质子数为6,核外电子数为6,有2个电子层,最外层4个电子,原子结构示意图为
,Y为C元素,质子数为6,核外电子数为6,有2个电子层,最外层4个电子,原子结构示意图为 ,
,
故答案为: ;
; ;
;
(3)Z为N元素,在元素周期表中的位置:第二周BA族,V为氯元素,处于周期表中:第三周期第ⅦA族,
故答案为:第二周期VA族;第三周期第ⅦA族;
(4)X的最高价氧化物为氧化钠,Z的最高价氧化物对应的水化物为HNO3,二者反应方程式为:Na2O+2HNO3═2NaNO3+H2O,
故答案为:Na2O+2HNO3═2NaNO3+H2O;
(5)非金属性越强最高价氧化物对应水化物的酸性越强,金属性越强最高价氧化物对应水化物的碱性越强,则按碱性减弱、酸性增强的顺序,各元素最高价氧化物对应水化物的分子式:NaOH、H2CO3、HNO3、HClO4,
故答案为:NaOH、H2CO3、HNO3、HClO4.
点评 本题考查结构性质位置关系应用,正确推断元素的种类为解答该题的关键,有利于基础知识的巩固.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案| A. | 12C、13C、14C、C60都是碳元素的同位素 | |
| B. | 同种元素的原子,质量数一定相同 | |
| C. | 互为同位素的原子,质子数一定相同 | |
| D. | 由一种元素组成的物质,一定是纯净物 |
| A. | 木炭的燃烧 | B. | 氢氧化钡晶体与氯化铵晶体混合 | ||
| C. | 镁条与稀硫酸的反应 | D. | 生石灰溶于水 |
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数是K层的三倍 |
| X | 最高化合价为+7价 |
| Y | 短周期主族元素原子中半径最大 |
| Z | 地壳中含量最多的金属元素 |
A、冷浓硝酸 B、热浓硫酸 C、浓盐酸 D、稀硝酸
(2)可用于扑灭Y单质燃烧引起的火灾的物质是C.
A、二氧化碳 B、水 C、沙土 D、干粉(主要成分为NaHCO3)
(3)元素X与元素T相比,非金属性较弱的是S(用元素符号表示).下列表述中能证明这一事实的是B.
A、在溶液中T的单质能置换出X的单质;
B、X的气态氢化物比T的气态氢化物更稳定
(4)四种元素的最高价氧化物中Z的最高价氧化物的化学特性是两性.
| A. | 向CH3CH2Br中加入NaOH溶液共热,再向反应后的溶液中滴入AgNO3溶液以检验溴元素 | |
| B. | 利用红外光谱图,可以鉴别CH3OCH3和CH3CH2OH | |
| C. | 向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热,以检验混合物中是否含有甲醛 | |
| D. | 苯不能与溴水发生取代反应,用苯能萃取溴的四氯化碳溶液中的溴 |
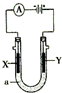 电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.下列正确的是( )
电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.下列正确的是( )| A. | 若X、Y为石墨,a为饱和NaCl溶液,向Y极附近加入酚酞,则Y极溶液呈红色 | |
| B. | 若X、Y是石墨,a为AgNO3溶液,电解一段时间后,溶液的pH减小 | |
| C. | 若用电解方法精炼粗铜,电解液a选用CuSO4溶液,X电极的材料是粗铜 | |
| D. | 若Y为铁,X为石墨,a为稀硫酸,Y电极反应为Fe-3e-=Fe3+ |