题目内容
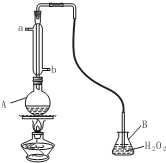
3.实验室里用二氧化锰和浓盐酸加热制取氯气,该反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,也可利用反应2KMn4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O制取并收集纯净、干燥的氯气,部分装置如图所示.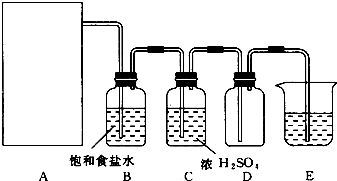
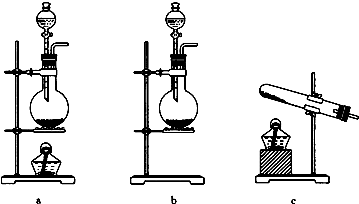
(1)若以KMnO4和浓盐酸为原料制取氯气,请根据反应原理从下图中选择合适的制气装置b(填代号).
(2)装置B的作用是除去氯气中的氯化氢.
(3)E中的试剂可选用A(填序号).
A.NaOH溶液 B、NaCl溶液 C、浓H2SO4 D、水
(4)某学生通过下列两种方式制取氯气:
①用8.7g MnO2与足量浓盐酸反应制取Cl2;
②用含14.6g HCl的浓盐酸与足量MnO2反应制取Cl2.
这两种方式产生Cl2的量的关系是A.
A.①多 B.②多 C.①②一样多.
分析 实验室里用二氧化锰和浓盐酸加热制取氯气,二者加热生成氯化锰、氯气和水;
(1)依据方程式2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O确定反应物状态和反应条件,据此选择发生装置;
(2)浓盐酸具有挥发性,制备的氯气中含有氯化氢,依据氯化氢、氯气在饱和食盐水溶解性不同选择除去氯化氢试剂;
(3)氯气有毒能够引起空气污染,不能直接排放,应进行尾气处理,E中试剂应能够与氯气反应吸收氯气;
(4)根据MnO2与浓HCl反应,随着反应的进行,浓HCl变稀,稀盐酸不能与MnO2反应,MnO2足量时,不能准确计算出氯气的量,浓盐酸足量时,能根据MnO2的质量计算出氯气的量.
解答 解:二氧化锰和浓盐酸加热生成氯化锰、氯气和水,反应的方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(1)依据方程式2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,反应物状态为固体与液体,反应条件为不加热,所以应选择装置b做发生装置;
故答案为:b;
(2)浓盐酸具有挥发性,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以可以选择盛有饱和食盐水的B装置除去氯气中的氯化氢;
故答案为:除去氯气中的氯化氢;
(3)氯气有毒能够引起空气污染,不能直接排放,应进行尾气处理,E作用为吸收过量的氯气,
浓硫酸不与氯气反应,不能吸收氯气,氯气在水中、氯化钠溶液中溶解度不大,所以不能用来吸收氯气,氢氧化钠溶液能与氯气反应生成氯化钠、次氯酸钠和水,可以用来吸收过量的氯气;
故选:A;
(4)依据方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
87g 146g 1mol
8.7g 14.6g 0.1mol
若①用8.7g MnO2与足量浓盐酸反应制取Cl2,则生成氯气的物质的量为0.1mol;
②用含14.6g HCl的浓盐酸与足量MnO2反应制取Cl2,因为随着反应进行盐酸浓度降低,变为稀盐酸,所以14.6g氯化氢不能完全反应,所以生成的氯气的物质的量小于0.1mol;
故选:A.
点评 本题考查氯气的制备,题目难度不大,熟悉氯气制备原理及发生装置选择依据是解题关键,注意氯气的实验室制法以及浓稀盐酸的性质的差异性,注意稀盐酸与二氧化锰不反应,题目难度不大.


注:图中,E表示能量,p表示压强,t表示时间,V表示体积.
| A. | ①表示化学反应H2(g)+Cl2(g)═2HCl(g)的能量变化,则该反应的反应热△H=+183 kJ/mol | |
| B. | ②表示其他条件不变时,反应4A(g)+3B(g)?2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是气体 | |
| C. | ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 | |
| D. | ④表示10 mL 0.1 mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1 mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液 |
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 常温常压下,17gNH3所含的原子数目为4NA | |
| C. | 1molNa2O2与H2O完全反应,转移2NA个电子 | |
| D. | 40gNaOH溶解在1L水中,得到的物质的量浓度为1mol/L |
| A. | 浓H2SO4 | B. | NaOH | C. | Br2的CCl4溶液 | D. | 酸性KMnO4溶液 |
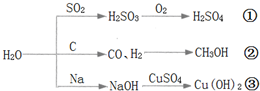
| A. | 图中所示的反应均为氧化还原反应 | |
| B. | 途径①是硫酸型酸雨的形成的重要途径 | |
| C. | 工业上可用途径②先制取水煤气,再合成甲醇等有机物 | |
| D. | 把金属钠投入到硫酸铜溶液中,发生途径③反应,反应不生成铜单质 |
 工业制硫酸尾气中的SO2,是一种空气污染物,同时也是一种重要的化工原料,采用氨吸收法进行循环利用,便可以变废为宝.
工业制硫酸尾气中的SO2,是一种空气污染物,同时也是一种重要的化工原料,采用氨吸收法进行循环利用,便可以变废为宝. ,Y
,Y .
.