题目内容
5.现有部分短周期主族元素的有关信息,如表:| 元素编号 | 元素性质或原子结构 |
| T | M层电子数是K层的三倍 |
| X | 最高化合价为+7价 |
| Y | 短周期主族元素原子中半径最大 |
| Z | 地壳中含量最多的金属元素 |
A、冷浓硝酸 B、热浓硫酸 C、浓盐酸 D、稀硝酸
(2)可用于扑灭Y单质燃烧引起的火灾的物质是C.
A、二氧化碳 B、水 C、沙土 D、干粉(主要成分为NaHCO3)
(3)元素X与元素T相比,非金属性较弱的是S(用元素符号表示).下列表述中能证明这一事实的是B.
A、在溶液中T的单质能置换出X的单质;
B、X的气态氢化物比T的气态氢化物更稳定
(4)四种元素的最高价氧化物中Z的最高价氧化物的化学特性是两性.
分析 短周期主族元素中,T原子的M层电子数是K层的三倍,则M层电子数为6,故T为S元素;X元素的最高化合价为+7价,则X为Cl;Y是短周期主族元素原子中半径最大的,则Y为Na;Z是地壳中含量最多的金属元素,则Z为Al.
解答 解:短周期主族元素中,T原子的M层电子数是K层的三倍,则M层电子数为6,故T为S元素;X元素的最高化合价为+7价,则X为Cl;Y是短周期主族元素原子中半径最大的,则Y为Na;Z是地壳中含量最多的金属元素,则Z为Al.
(1)Al单质在冷的浓硫酸、浓硝酸中发生钝化现象,不能溶解,可以溶解于热的浓硫酸、热的浓硝酸、浓盐酸、稀硝酸,
故答案为:A;
(2)钠失火会生成过氧化钠,二氧化碳能与过氧化钠反应生成氧气,钠、过氧化钠与水反应分别生成氢气、氧气,干粉受热分解会得到二氧化碳与水,可以用沙土隔绝空气进行灭火,
故答案为:C;
(3)同周期自左而右非金属性增强,故非金属性S<Cl,
A.在溶液中硫的单质不能置换出氯气,故A错误;
B.X的气态氢化物比T的气态氢化物更稳定,说明X的非金属性更强,故B正确,
故答案为:S;B;
(4)四种元素的最高价氧化物中Z的最高价氧化物为氧化铝,属于两性氧化物,
故答案为:两性.
点评 本题考查结构性质物质关系应用,比较基础,注意掌握元素化合物知识,掌握金属性、非金属性强弱比较.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
16.水的电离过程为:H2O?H++OH-,在不同温度下其平衡常数为Kw(25℃)=1.0×10-14,Kw(35℃)=2.1×10-14.则下列叙述正确的是( )
| A. | c(H+)随着温度升高而降低 | B. | 在35℃时,c(H+)>c(OH-) | ||
| C. | 蒸馏水中通HCl,Kw增大 | D. | 温度升高有利于水的电离 |
20.A~D六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示.
请回答下列问题:
(1)A在元素周期表中的位置是第三周期ⅡA族.
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是Cu+2Fe3+=2Fe2++Cu2+.
(3)用电子式表示MgCl2的形成过程 .
.
| 元素 | 原子结构或性质 |
| A | 原子最外层电子数是内层电子总数的1/5 |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
(1)A在元素周期表中的位置是第三周期ⅡA族.
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是Cu+2Fe3+=2Fe2++Cu2+.
(3)用电子式表示MgCl2的形成过程
 .
.
17.下列各组酸中,酸性依次增强的是( )
| A. | H2CO3 H2SiO3 H3PO4 | B. | HNO3 H3PO4 H2SO4 | ||
| C. | HI HBr HCl | D. | HClO HNO3 HClO4 |
14.下列分散系中,属于胶体的是( )
| A. | 稀豆浆 | B. | 氯化钠溶液 | C. | 硝酸银溶液 | D. | 氯化铁溶液 |
15.能正确表示下列反应的离子方程式是( )
| A. | 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2 | |
| B. | 向FeCl3溶液中加Mg(OH)2:3 Mg(OH)2+2Fe3+=2Fe(OH)3+3 Mg2+ | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ |
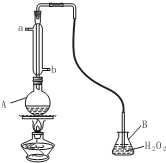 工业制硫酸尾气中的SO2,是一种空气污染物,同时也是一种重要的化工原料,采用氨吸收法进行循环利用,便可以变废为宝.
工业制硫酸尾气中的SO2,是一种空气污染物,同时也是一种重要的化工原料,采用氨吸收法进行循环利用,便可以变废为宝. ,Y
,Y .
.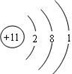 ;F元素在周期表中的位置是第三周期ⅦA族;
;F元素在周期表中的位置是第三周期ⅦA族;