题目内容
14.在100mL0.3moL•L-1的A1Cl3溶液中,加入2.3g钠块,待其充分反应后,若忽略溶液体积的变化,下列说法正确的是( )| A. | 反应后溶液为澄清状态 | |
| B. | 反应后溶液中AlO2-浓度为0.1 mo L•L-1 | |
| C. | 反应后溶液中离子浓度最大的是Cl- | |
| D. | 溶液中Al3+与AlO2-浓度之比为2:1 |
分析 n(Na)=$\frac{2.3g}{23g/mol}$=0.1mol,由Na原子守恒可知Na与水反应生成NaOH为0.1mol,n(A1Cl3)=0.1L×0.3mol/L=0.03mol,发生A1Cl3+3NaOH=Al(OH)3↓+3NaCl、Al(OH)3+OH-=AlO2-+2H2O,以此来解答.
解答 解:n(Na)=$\frac{2.3g}{23g/mol}$=0.1mol,n(NaOH)=0.1mol,n(A1Cl3)=0.1L×0.3mol/L=0.03mol,
A1Cl3+3NaOH=Al(OH)3↓+3NaCl
0.03mol 0.09mol 0.03mol
Al(OH)3+OH-=AlO2-+2H2O
0.01mol 0.01mol 0.01mol
则最终还生成0.02mol沉淀,不含铝离子,AlO2-浓度为$\frac{0.01mol}{0.1L}$=0.1mol/L,c(Cl-)=0.3mol/L×3=0.9mol/L,c(Na+)=$\frac{0.1mol}{0.1L}$=1mol/L,
故选B.
点评 本题考查化学反应的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意钠离子、氯离子浓度的计算,题目难度不大.

练习册系列答案
相关题目
4.下列溶液中的Cl-浓度与50ml1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 75mL2mol•L-1 CaCl2溶液 | B. | 150mL2mol•L-1NaCl溶液 | ||
| C. | 150mL2mol•L-1KClO3溶液 | D. | 75mL1mol•L-1 AlCl3溶液 |
5.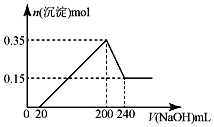 将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )
将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )
 将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )
将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )| A. | NaOH溶液的物质的量浓度为2.5mol•L-1 | |
| B. | 盐酸的物质的量浓度为5mol•L-1 | |
| C. | 镁和铝的总质量为9g | |
| D. | 生成的氢气在标准状况下的体积为11.2L |
2.在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24.下列有关说法中正确的是( )
| A. | 25℃时,CuS的溶解度大于ZnS的溶解度 | |
| B. | 25℃时,向含有等物质的量的FeCl2、CuCl2的混合液中逐滴加入Na2S,最先出现沉淀的是FeS | |
| C. | 除去ZnCl2溶液中的Cu2+,可以选用FeS作沉淀剂 | |
| D. | 将足量CuSO4溶解在0.1 mol/L的H2S溶液中,S2-能达到的最大浓度为$\sqrt{1.3}$×10-18mol/L |
6.已知20℃,两种一元弱酸的钠盐NaX和NaY,已知往NaX溶液中通入少量CO2只能生成HX和NaHCO3;往NaY溶液中通入少量CO2能生成HY和Na2CO3,下列说法正确的是( )
| A. | 酸性HX<HY | |
| B. | 结合H+的能力Y->CO32->X->HCO3- | |
| C. | 溶液的碱性NaX>Na2CO3>NaY>NaHCO3 | |
| D. | HX和HY酸性相同,但比H2CO3弱 |
3.X、Y、Z、W均为短周期元素,原子序数依次增大.Y原子的M电子层有1个电子,同周期的简单离子的半径中Z最小.W与X同主族,其最高化合价是最低负化合价绝对值的3倍.下列说法正确的是( )
| A. | 原子半径的大小:W>Z>Y | |
| B. | 简单气态氢化物的热稳定性:W>X | |
| C. | Y、Z、W最高价氧化物对应水化物能够两两发生反应 | |
| D. | 简单离子的还原性:X>W |
4.下列表示不正确的是( )
| A. | CO2的电子式 | B. | Cl2的结构式:Cl-Cl | ||
| C. | CH4的球棍模型 | D. | Clˉ离子的结构示意图  |
 (1)估计下列各变化过程是熵增还是熵减.
(1)估计下列各变化过程是熵增还是熵减.