题目内容
12.工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯: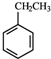 (g)+CO2(g)?
(g)+CO2(g)?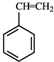 (g)+CO(g)+H2O(g)△H=-166KJ/mol
(g)+CO(g)+H2O(g)△H=-166KJ/mol(1)在3L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为1.0mol/L和3.0mol/L,其中实验Ⅰ在T1℃,0.3MPa,而实验II、III分别改变了实验其他条件;乙苯的浓度随时间的变化如图Ⅰ所示.

①实验I乙苯在0-50min时的反应速率为0.012mol/(L•min)
②实验Ⅱ可能改变条件的是催化剂
③图II是实验Ⅰ中苯乙烯体积分数V%随时间t的变化曲线,请在图II中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线.
(2)若实验Ⅰ中将乙苯的起始浓度改为1.2mol/L,其他条件不变,乙苯的转化率将减小(填“增大”、“减小”或“不变”),计算此时平衡常数为0.225.
分析 (1)①实验I乙苯在0-50min内浓度变化量为(1-0.4)mol/L=0.6mol/L,再根据v=$\frac{△c}{△t}$计算;
②实验Ⅱ与实验I相比,反应速率加快,但平衡不移动,应是加入催化剂;
③实验Ⅲ与实验I相比,反应速率加快,开始阶段相同时间内实验Ⅲ中苯乙烯的体积分数较大,但平衡时乙苯的浓度增大,平衡逆向移动,平衡时苯乙烯的体积分数小于实验I;
(2)若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,等效压强增大到达平衡后在移走部分二氧化碳,增大压强平衡逆向移动,移走二氧化碳平衡逆向移动;
计算实验Ⅰ中平衡时时各组分的浓度,代入平衡常数K=$\frac{c({C}_{6}{H}_{5}CH=C{H}_{2})×c(CO)×c({H}_{2}O)}{c({C}_{6}{H}_{5}C{H}_{2}C{H}_{3})×c(C{O}_{2})}$计算.
解答 解(1)①根据图I中可知,0-50min时乙苯的浓度变化为:1.0mol/L-0.4mol/L=0.6mol/L,则乙苯的反应速率v=$\frac{0.6mol/L}{50min}$=0.012mol/(L•min),故答案为:0.012mol/(L•min);
②实验Ⅱ与实验I相比,反应速率加快,但平衡不移动,应是加入催化剂,故答案为:加催化剂;
③实验Ⅲ与实验I相比,反应速率加快,开始阶段相同时间内实验Ⅲ中苯乙烯的体积分数较大,但平衡时乙苯的浓度增大,平衡逆向移动,平衡时苯乙烯的体积分数小于实验I,则实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线为 ,
,
故答案为: ;
;
(2)若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,等效压强增大到达平衡后在移走部分二氧化碳,增大压强平衡逆向移动,移走二氧化碳平衡逆向移动,故所以乙苯的转化率减小;
根据图I中实验1可知,0-50min时乙苯的浓度变化为1.0mol/L-0.4mol/L=0.6mol/L
C6H5CH2CH3+CO2?C6H5CH=CH2 +CO+H2O
起始浓度(mol/L):1.0 3.0 0 0 0
反应浓度(mol/L):0.6 0.6 0.6 0.6 0.6
平衡浓度(mol/L):0.4 2.4 0.6 0.6 0.6
则平衡常数K=$\frac{c({C}_{6}{H}_{5}CH=C{H}_{2})×c(CO)×c({H}_{2}O)}{c({C}_{6}{H}_{5}C{H}_{2}C{H}_{3})×c(C{O}_{2})}$=$\frac{0.6×0.6×0.6}{0.4×2.4}$=0.225,
故答案为:减小;0.225.
点评 本题考查化学平衡影响因素、反应速率计算、化学平衡常数的计算,题目难度中等,(1)中作图为易错点,学生容易考虑到达平衡时间及苯乙烯体积分数,易忽略开始阶段相同时间内实验Ⅲ中苯乙烯的体积分数较大.

 阅读快车系列答案
阅读快车系列答案| A. | 铁和硫酸铜溶液反应得到铜 | |
| B. | 铁和稀盐酸反应生成H2和FeCl2 | |
| C. | 铁高温下和水蒸气反应生成H2和Fe2O3 | |
| D. | 铁在氧气中燃烧生成Fe3O4 |
(1)a>(填“>”、“=”或“<”)b.
(2)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<(填“>”、“<”或“=”)T2.
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
(3)在相同条件下要得到2a KJ热量,加入各物质的物质的量可能是D.
A.4mol A2和2mol B2 B.4mol A2、2mol B2和2mol C3
C.4mol A2和4mol B2 D.6mol A2和4mol B2
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,500℃时充分反应达到平衡后,放出热量d kJ,则d>(填“>”、“=”或“<”)b,理由是由于恒压容器中压强比恒容容器中的大,故反应物的转化率较高,生成C3比恒容时多,则放出的热量也多.
(6)在一定温度下,向一个容积不变的容器中通入2mol A2和1mol B2及适量固体催化剂,使反应达到平衡.保持同一反应温度,在相同容器中,将起始物质改为4mol A2、2mol B2,则平衡时A2的转化率变大(填“不变”、“变大”“变小”或“不能确定”).
的电极反应为( )
| A. | C2H5OH-12e-+12OH-═2CO2+9H2O | B. | O2+4H++4e-═2H2O | ||
| C. | O2+2H2O+4e-═4OH- | D. | C2H5OH+16OH--12e-═2CO32-+11H2O |

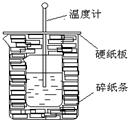 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: