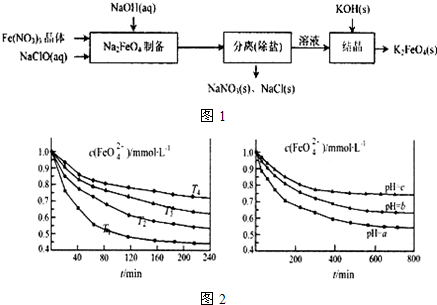
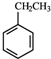
题目内容
20.已知2A2(g)+B2(g)?2C3(g)△H=-a kJ/mol(a>0),在一个有催化剂、固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达到平衡后C3的浓度为x mol•L-1,放出热量b KJ.请回答下列问题.(1)a>(填“>”、“=”或“<”)b.
(2)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<(填“>”、“<”或“=”)T2.
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
(3)在相同条件下要得到2a KJ热量,加入各物质的物质的量可能是D.
A.4mol A2和2mol B2 B.4mol A2、2mol B2和2mol C3
C.4mol A2和4mol B2 D.6mol A2和4mol B2
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,500℃时充分反应达到平衡后,放出热量d kJ,则d>(填“>”、“=”或“<”)b,理由是由于恒压容器中压强比恒容容器中的大,故反应物的转化率较高,生成C3比恒容时多,则放出的热量也多.
(6)在一定温度下,向一个容积不变的容器中通入2mol A2和1mol B2及适量固体催化剂,使反应达到平衡.保持同一反应温度,在相同容器中,将起始物质改为4mol A2、2mol B2,则平衡时A2的转化率变大(填“不变”、“变大”“变小”或“不能确定”).
分析 (1)热化学方程式表达的意义为:当2mol A2和1mol B2完全反应时,放出热量为akJ,而该反应为可逆反应,加入的2mol不能完全转化;
(2)正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
若在原来的容器中,只加入2mol C3,与加入2mol A2和1mol B2建立完全相同的平衡状态,平衡时C3的浓度相等,则a=b+c;
(3)在相同条件下要得到2a KJ热量,则参加反应的A2应4mol,结合可逆反应不能完全转化判断;
(4)A.及时分离出C3气体,反应速率减慢;
B.适当升高温度,平衡逆向移动;
C.增大B2的浓度,加快反应速率,平衡正向移动;
D.选择高效的催化剂不影响平衡移动;
(5)恒温恒容下,正反应为气体物质的量减小的反应,平衡时压强减小,若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,等效为在原平衡的基础上增大压强,反应物转化率增大;
(6)保持同一反应温度,在相同容器中,将起始物质改为4mol A2、2mol B2,等效为在原平衡的基础上增大压强.
解答 解:(1)热化学方程式表达的意义为:当2mol A2和1mol B2完全反应时,放出热量为akJ,而该反应为可逆反应,而加入2mol A2和1mol B2达到平衡时,没有完全反应,释放的热量小于完全反应释放的热量,即a>b,故答案为:>;
(2)正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,故温度表中T1<T2;
若在原来的容器中,只加入2mol C3,与加入2mol A2和1mol B2建立完全相同的平衡状态,平衡时C3的浓度相等,即则C3的浓度=x mol•L-1,则a=b+c,
故答案为:<;=;a=b+c;
(3)在相同条件下要得到2a KJ热量,则参加反应的A2应4mol,可逆反应不能完全转化,故A2的起始物质的量应大于4mol,选项中只有D符合,
故选:D;
(4)A.及时分离出C3气体,平衡正向移动,但反应速率减慢,故A错误;
B.适当升高温度,提供反应速率,正反应为放热反应,平衡逆向移动,故B错误
C.增大B2的浓度,加快反应速率,平衡正向移动,故C正确;
D.选择高效的催化剂加快反应速率,但不影响平衡移动,故D错误,
故选:C;
(5)恒温恒容下,正反应为气体物质的量减小的反应,平衡时压强减小,若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,等效为在原平衡的基础上增大压强,反应物转化率增大,生成C3比恒容时多,则放出的热量也多,故d>b,
故答案为:>;由于恒压容器中压强比恒容容器中的大,故反应物的转化率较高,生成C3比恒容时多,则放出的热量也多;
(6)保持同一反应温度,在相同容器中,将起始物质改为4mol A2、2mol B2,等效为在原平衡的基础上增大压强,平衡正向移动,则平衡时A2的转化率变大,
故答案为:变大.
点评 本题考查化学平衡计算、化学平衡影响因素等,注意利用等效思想分析解答,难度中等.

 )甲酯并计算其产率.实验步骤如下:
)甲酯并计算其产率.实验步骤如下:Ⅰ.如图,在三颈烧瓶中加入6.9g (0.05mol)水杨酸和24g(30mL,0.75mol)甲醇,以及约10mL甲苯(甲苯与
 水形成的共沸物,其沸点为85℃;该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀后加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
水形成的共沸物,其沸点为85℃;该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀后加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯5.3g.
常用物理常数如下:
| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
(1)仪器A的名称是冷凝管,制备水杨酸甲酯时,最合适的加热方法是水浴加热.
(2)实验中加入沸石的作用是防暴沸;
(3)加入甲苯的作用是将反应产生的水从反应体系中分离出来,使合成水杨酸甲酯反应的化学平衡向右移动,从而提高反应的产率.
(4)反应结束后,分离甲醇所采用操作的名称是蒸馏.
(5)洗涤操作中,前后两次水洗的目的分别是为了洗掉洗掉大部分硫酸和洗掉碳酸氢钠.
(6)在蒸馏操作中,仪器选择及安装都正确的是(填标号)b.

(7)本实验的产率为70%(保留两位有效数字).
| A. | 原子最外层电子数大于4的元素可能是金属元素 | |
| B. | 含有共价键的物质一定是共价化合物 | |
| C. | 离子化合物中只可能含有离子键而不可能含有共价键 | |
| D. | 多种非金属元素之间形成的共价键一定是极性键 |
| A. | H2O2的电子式: | B. | C2H4的结构式:CH2=CH2 | ||
| C. | 硫原子结构示意图: | D. | 乙醇的分子式:C2H6O |

 (g)+CO2(g)?
(g)+CO2(g)?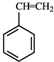 (g)+CO(g)+H2O(g)△H=-166KJ/mol
(g)+CO(g)+H2O(g)△H=-166KJ/mol