题目内容
1.下列关于钢铁腐蚀与防护的说法正确的是( )| A. | 钢铁的吸氧腐蚀和析氢腐蚀的正极反应式均为:Fe-2e-═Fe2+ | |
| B. | 钢铁发生吸氧腐蚀时,负极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 地下钢管连接镁块防腐的方法为“牺牲阳极的阴极保护法” | |
| D. | 钢铁发生吸氧腐蚀时,钢铁制品的质量一定减轻 |
分析 A.钢铁发生吸氧腐蚀或析氢腐蚀时,负极上都是Fe失电子发生氧化反应,发生吸氧腐蚀时,正极上氧气得电子发生还原反应,发生析氢腐蚀时,正极上氢离子得电子发生还原反应;
B.钢铁发生吸氧腐蚀时,负极上Fe失电子发生氧化反应,正极上氧气得电子发生还原反应;
C.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护,属于牺牲阳极的阴极保护法;
D.钢铁发生吸氧腐蚀时,钢铁制品质量增加.
解答 解:A.钢铁发生吸氧腐蚀或析氢腐蚀时,负极上都是Fe失电子发生氧化反应,负极反应式为Fe-2e-═Fe2+;发生吸氧腐蚀时,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-═4OH-;发生析氢腐蚀时,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-═H2↑,故A错误;
B.钢铁发生吸氧腐蚀时,负极上Fe失电子发生氧化反应,负极反应式为Fe-2e-═Fe2+;正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-═4OH-,故B错误;
C.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护,属于牺牲阳极的阴极保护法,Mg、Fe和电解质溶液构成原电池时,Mg易失电子作负极、Fe作正极,Fe被保护,属于牺牲阳极的阴极保护法,故C正确;
D.钢铁发生吸氧腐蚀时,负极反应式为Fe-2e-═Fe2+;发生吸氧腐蚀时,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-═4OH-,Fe2+和OH-反应生成Fe(OH)2,Fe(OH)2被氧气氧化生成Fe(OH)3,导致钢铁制品质量增加,故D错误;
故选C.
点评 本题考查金属腐蚀与防护,为高频考点,明确原电池原理是解本题关键,知道钢铁发生吸氧腐蚀和析氢腐蚀的区别,难点是电极反应式的书写,题目难度不大.

 的物质是( )
的物质是( )| A. | 丙烷 | B. | 丁烷 | C. | 丙烯 | D. | 丁烯 |
| A. | Na2O、Na2O2都属于氧化物 | B. | H2SO4、CH3COOH都属于酸 | ||
| C. | 烧碱、纯碱都属于碱 | D. | Na2CO3、NaHCO3都属于盐 |
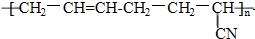 具有优良的耐油、耐高温性能,则合成丁晴橡胶的单体种类和化学反应所属类型分别是( )
具有优良的耐油、耐高温性能,则合成丁晴橡胶的单体种类和化学反应所属类型分别是( )| A. | 1种 加聚反应 | B. | 2种 缩聚反应 | C. | 2种 加聚反应 | D. | 3种 缩聚反应 |
| A. | 中性溶液AG=0 | |
| B. | 常温下0.1mol/L氢氧化钠溶液的AG=12 | |
| C. | 酸性溶液AG<0 | |
| D. | 常温下0.1mol/L的盐酸溶液的AG=13 |
| A. | 石油裂解、石油分馏、煤的干馏都是化学变化 | |
| B. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| C. | 在一定条件下,苯和液溴、硝酸作用生成溴苯、硝基苯都属于取代反应 | |
| D. | 苯和甲苯都不属于芳香烃 |
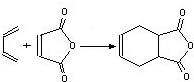
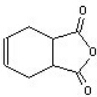 互为同分异构体,一定条件下能与氯化铁溶液发生显色反应,且与NaHCO3溶液反应放出CO2,则该有机物有13种.
互为同分异构体,一定条件下能与氯化铁溶液发生显色反应,且与NaHCO3溶液反应放出CO2,则该有机物有13种. ,请用合成反应的流程图,表示出最合理的合成方案(注明反应条件):
,请用合成反应的流程图,表示出最合理的合成方案(注明反应条件):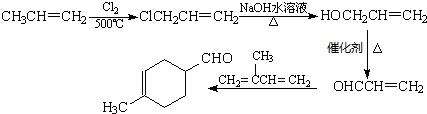 .
.