题目内容
7.下列反应的离子方程式书写正确的是( )| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 氨水中通入过量二氧化碳:2NH3•H2O+CO2═CO32-+2NH4++H2O | |
| D. | 溴化亚铁溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- |
分析 A.不符合反应客观事实;
B.碳酸氢钠过量,反应生成碳酸钙和水;
C.二氧化碳过量反应生成碳酸氢铵;
D.二价铁离子还原性强于溴离子,氯气少量氧化二价铁离子;
解答 解:A.氯化铝与氨水反应生成氢氧化铝和氯化铵,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故A错误;
B.澄清石灰水与过量小苏打溶液混合,离子方程式:Ca2++2OH-+2HCO3-═2CaCO3↓+2H2O,故B错误;
C.氨水中通入过量二氧化碳,生成碳酸氢铵,离子方程式:NH3•H2O+CO2═NH4++HCO3?,故C错误;
D.溴化亚铁溶液中通入少量氯气,只氧化二价铁离子,反应离子方程式:2Fe2++Cl2═2Fe3++2Cl-,故D正确;
故选:D.
点评 本题考查离子方程式的书写,题目难度不大,注意从化学式、离子符号、电荷守恒以及是否符合反应实际的角度分析,注意反应物用量对反应的影响.

练习册系列答案
相关题目
17.下列说法正确的是( )
| A. | 原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 | |
| B. | Zn2+的最外层电子排布式为3s23p63d10 | |
| C. | 基态铜原子的外围电子排布图: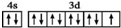 | |
| D. | 基态碳原子的最外层电子排布图: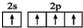 |
18.下列分离、提纯物质的方法不正确的是( )
| A. | 用分液的方法分离汽油和水的混合物 | |
| B. | 用蒸馏的方法提取碘水中的碘 | |
| C. | 用溶解、过滤的方法提纯含有少量Ba(OH)2的BaSO4 | |
| D. | 用升华的方法除去固体食盐中的I2 |
15.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1 NaAlO2溶液:Al3+、Na+、Cl-、NO3- | |
| B. | 由水电离出的c(H+)•c(OH-)=10-22的溶液:Na+、Ca2+、HCO3-、NO3- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、HCO3-、SO42-、CO32- | |
| D. | 0.1 mol•L-1盐酸的澄清透明溶液:Fe3+、K+、SO42-、Br- |
2.化学知识在生活中有重要意义,下列说法正确的是( )
| A. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| B. | 小苏打用于治疗胃溃疡病人的胃酸过多症 | |
| C. | 计算机芯片所用的材料是高纯度的二氧化硅 | |
| D. | 捕获工业排放的CO2能降低地球的温室效应 |
12.下列几种说法中正确的是( )
| A. | 摩尔是化学上常用的一个物理量 | |
| B. | 某物质含有6.02×1023个微粒,含有这个数目微粒的物质一定是1 mol | |
| C. | 1摩尔氢气分子可以表示为1 mol H2 | |
| D. | 硫酸的摩尔质量为98 g |
16. 金属及其化合物渗透在生活中的方方面面,其对我们的生活影响很大.
金属及其化合物渗透在生活中的方方面面,其对我们的生活影响很大.
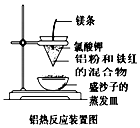
(1)铝热反应可以用于野外焊接钢轨.如图是某同学在实验室中进行
铝热反应(铝过量)的实验装置,实验中他观察到的现象之一为“纸漏斗
的下部被烧穿,有熔融物落入沙中”.
①根据装置图,判断该铝热反应的铝热剂为(写化学式)Al、Fe2O3.
②为定性检验铝热反应后的固体成分,请补充填写下表:
(2)某锂离子电池正极材料含有钴酸锂(LiCoO2),其正极材料可再生利用,其中一步反 应是在加热条件下利用硫酸酸化的双氧水和钴酸锂反应得到CoSO4,写出该反应的化学方程式2LiCoO2+H2O2+3H2SO4═Li2SO4+2CoSO4+O2↑+4H2O
(3)纳米铁粉(Fe)可用于处理地下水中的污染物.一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为2Fe2++BH4-+4OH-=2Fe+2H2↑+B(OH)4-.
(4)某酸性工业废水中含有有毒的K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,现有1000L含 21.6mg/L的Cr2O72-溶液,需要27.0g草酸可以完全处理掉Cr2O72-(结果保留3位有效数字).
 金属及其化合物渗透在生活中的方方面面,其对我们的生活影响很大.
金属及其化合物渗透在生活中的方方面面,其对我们的生活影响很大.(1)铝热反应可以用于野外焊接钢轨.如图是某同学在实验室中进行
铝热反应(铝过量)的实验装置,实验中他观察到的现象之一为“纸漏斗
的下部被烧穿,有熔融物落入沙中”.
①根据装置图,判断该铝热反应的铝热剂为(写化学式)Al、Fe2O3.
②为定性检验铝热反应后的固体成分,请补充填写下表:
| 检验成分 | 操作步骤 | 实验现象与相关解释或结论 |
| 铝 | 取少量反应后的固体于试管中,加入足量NaOH溶液,振荡 | ①加入NaOH溶液后,固体部分溶解,用化学方程式解释原因Al2O3+2NaOH=2NaAlO2+H2O ②观察到有气泡产生,证明存在Al. |
| 铁红 | ①另取少量反应后的固体于试管中,加入足量稀硫酸, ②(继续填写后续操作)向试管中滴加KSCN溶液 | ①加入硫酸,固体全部溶解, ②现象为溶液变红色,则证明存在铁红 |
(3)纳米铁粉(Fe)可用于处理地下水中的污染物.一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为2Fe2++BH4-+4OH-=2Fe+2H2↑+B(OH)4-.
(4)某酸性工业废水中含有有毒的K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,现有1000L含 21.6mg/L的Cr2O72-溶液,需要27.0g草酸可以完全处理掉Cr2O72-(结果保留3位有效数字).
2.下列实验操作正确的是( )
| A. |  稀释浓硫酸 | B. |  加热液体 | C. |  点燃酒精灯 | D. |  称量NaOH固体 |