题目内容
19.设NA为阿伏加德罗常数的值,下列叙述正确的是( )①46g NO2和N2O4混合气体中含有的原子数为3NA
②标准状况下22.4L H2中含有的中子数为2NA
③1L 1mol/L的醋酸溶液中含有的离子总数为2NA
④1mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA电子
⑤9g重水(D2O)所含有的电子数为5NA
⑥1L 1mol/L的MgCl2溶液中含有的离子数为2NA
⑦7.1g氯气与足量NaOH溶液反应,转移的电子数为0.2NA
⑧1mol C10H22分子中共价键总数为31NA
⑨2L 3mol/L的Na2CO3溶液中含CO32-的数目为6NA
⑩1.8g NH4+中含有的电子数为NA.
| A. | ①③⑥⑨⑩ | B. | ②④⑤⑥ | C. | ①④⑧⑩ | D. | ④⑥⑦⑧⑩ |
分析 ①NO2和N2O4的最简式均为NO2;
②氢气中不含中子;
③醋酸是弱电解质,不能完全电离;
④Mg反应后变为+2价;
⑤求出9g重水(D2O)的物质的量让,然后根据重水中含10个电子来分析;
⑥镁离子的水解会导致离子个数增多;
⑦求出7.1g氯气的物质的量,然后根据氯气和碱反应为歧化反应来分析;
⑧C10H22分子中含31条共价键来分析;
⑨CO32-在溶液中会水解;
⑩求出1.8g NH4+的物质的量,然后根据铵根离子中含10个电子来分析.
解答 解:①NO2和N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为1mol,故含3NA个原子,故正确;
②氢气中不含中子,故标况下22.4L氢气中含有的中子个数为0,故错误;
③醋酸是弱电解质,不能完全电离,故溶液中的离子个数无法计算,故错误;
④Mg反应后变为+2价,故1mol镁无论产物是什么,则均失去2NA个电子,故正确;
⑤9g重水(D2O)的物质的量为0.45mol,而重水中含10个电子,故0.45mol重水中含4.5NA个电子,故错误;
⑥镁离子的水解会导致离子个数增多,故溶液中的离子个数多于3NA个,故错误;
⑦7.1g氯气的物质的量为0.1mol,而氯气和碱反应为歧化反应,故0.1mol氯气转移0.1NA个电子,故错误;
⑧C10H22分子中含31条共价键,故1molC10H22分子中含31NA条共价键,故正确;
⑨CO32-在溶液中会水解,故溶液中的碳酸根的个数小于6NA个,故错误;
⑩1.8g NH4+的物质的量为0.1mol,而铵根离子中含10个电子,故0.1mol铵根离子中含电子数为NA个,故正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

| A. | 用食醋清洗热水瓶中的水垢 | |
| B. | 红宝石、珍珠、玛瑙、水晶、钻石等装饰品的主要成分都是硅酸盐 | |
| C. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关 | |
| D. | 绿色化学的核心是利用化学原理从源头上减少或消除工业生产对环境的污染 |
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 氨水中通入过量二氧化碳:2NH3•H2O+CO2═CO32-+2NH4++H2O | |
| D. | 溴化亚铁溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- |
| A. |  观察Fe(OH)2的生成 | B. |  中和滴定 | ||
| C. |  除去CO2气体中的HCl气体 | D. | 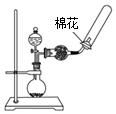 制取并收集干燥的氨气 |
| A. | 78gNa2O2固体中阴离子的个数为2NA | |
| B. | 标准状况1.12L氯气与H2O反应,反应中转移的电子数为0.1NA | |
| C. | CO2通过Na2O2使其增重ag时,反应中转移的电子数为$\frac{a{N}_{A}}{56}$ | |
| D. | 60gSiO2含有的化学键数目为4NA |
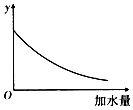
| A. | 溶液的pH | B. | 醋酸的电离平衡常数 | ||
| C. | 溶液中醋酸的物质的量浓度 | D. | 醋酸的电离程度 |
| A. | 1.0 L 1.0mol•L-1的KClO4水溶液中含有的氧原子数为4NA | |
| B. | 28g CH3=CH-CH3和 的混合物中所含共用电子对数目为6NA 的混合物中所含共用电子对数目为6NA | |
| C. | 25℃时pH=1的H2SO4溶液中含有H+的数目为0.2NA | |
| D. | 0.1mol 3H37Cl分子中所含中子数为2.3NA |