题目内容
5.反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,下列条件的改变能使反应速率加快的是( )①增加铁的量 ②将容器的体积缩小一半
③保持体积不变,充入N2使体系压强增大 ④保持体积不变,充入水蒸汽使体系压强增大.
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
分析 对于反应3Fe(s)+4H2O(g)?Fe3O4+4H2(g)来说,增大压强、浓度、升高温度以及增大固体的表面积,都可增大反应速率,以此解答;
解答 解:①Fe为固体,增加铁的量,反应速率不变,故A①错误;
②将容器的体积缩小一半,气体浓度增大,反应速率增大,正逆反应速率增大,故B②正确;
③保持体积不变,充入N2使体系压强增大,各组分的浓度不变,反应速率不变,故③错误;
④保持体积不变,充入水蒸气使体系压强增大,反应物浓度增大,反应速率增大,故④正确;
故选D.
点评 本题考查化学反应速率,为高频考点,侧重于学生的分析能力和基本理论、概念的综合理解和运用的考查,难度不大,注意相关基础知识的积累,易错点为④,注意压强与浓度的关系.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
7.下列离子方程式正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+H+═H2O+CO2 | |
| B. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2 | |
| C. | 硝酸与氢氧化钡反应:OH-+H+═H2O | |
| D. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag |
17.配制一定物质的量浓度的氢氧化钠溶液,造成浓度偏高的操作是( )
| A. | 所用的氢氧化钠固体放置于空气中过久 | |
| B. | 定容时,眼睛俯视刻度线 | |
| C. | 洗涤烧杯和玻璃棒的溶液未转入容量瓶中 | |
| D. | 定容后摇匀,发现液面低于刻度线,不作处理 |
14.钢铁因锈蚀每年造成大量的损失.钢铁在潮湿的空气中会发生电化学腐蚀,最普遍的正极反应是( )
| A. | 2H2O+O2+4e-=4OH- | B. | Fe-2e-=Fe2+ | ||
| C. | 2H++2e-=H2↑ | D. | Fe-3e-=Fe3+ |
 (1)8.4g N2与9.6g某单质Rx所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是16,x值为3.
(1)8.4g N2与9.6g某单质Rx所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是16,x值为3.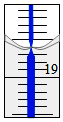 氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.完成下列填空:
氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.完成下列填空:

 的名称2-硝基甲苯(邻硝基甲苯).
的名称2-硝基甲苯(邻硝基甲苯).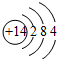 .
.