题目内容
硫酸铁铵[aFe2(SO4)3?6(NH4)2SO4?cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等.某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵.

请回答下列问题:
(1)硫酸亚铁溶液加H2SO4酸化的主要目的是 ,滤渣A的主要成分是 .
(2)下列物质中最适合的氧化剂B是 .
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲、乙的名称分别是:甲 ,乙 .
(4)上述流程中,有一处不严密,请指出并修改 .
(5)称取14.00g样品,将其溶于水配制成100mL溶液,并分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14g沉淀;向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应.则该硫酸铁铵的化学式为 .

请回答下列问题:
(1)硫酸亚铁溶液加H2SO4酸化的主要目的是
(2)下列物质中最适合的氧化剂B是
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲、乙的名称分别是:甲
(4)上述流程中,有一处不严密,请指出并修改
(5)称取14.00g样品,将其溶于水配制成100mL溶液,并分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14g沉淀;向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应.则该硫酸铁铵的化学式为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:原料中加入硫酸酸化,可生成硫酸钙沉淀,减压过滤后加入过氧化氢氧化可生成硫酸铁,加入硫酸铵,在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵,结合对应物质的性质以及题目要求可解答该题.
(1)硫酸亚铁中亚铁离子水解,硫酸可以抑制水解,硫酸根离子可以将钙离子沉淀,据此回答;
(2)为避免引入新杂质,应加入过氧化氢为氧化剂;
(3)硫酸铁铵经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵,但是温度不能太高;
(4)根据硫酸铁铵中铵根离子、铁离子的水解来回答;
(5)根据元素守恒结合发生的转化来计算.
(1)硫酸亚铁中亚铁离子水解,硫酸可以抑制水解,硫酸根离子可以将钙离子沉淀,据此回答;
(2)为避免引入新杂质,应加入过氧化氢为氧化剂;
(3)硫酸铁铵经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵,但是温度不能太高;
(4)根据硫酸铁铵中铵根离子、铁离子的水解来回答;
(5)根据元素守恒结合发生的转化来计算.
解答:
解:原料中加入硫酸酸化,可生成硫酸钙沉淀,减压过滤后加入过氧化氢氧化可生成硫酸铁,加入硫酸铵,在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵,
(1)加入硫酸,可增大溶液中SO42-浓度,将Ca2+转化为沉淀,生成CaSO4,同时抑制Fe2+水解,
故答案为:增大溶液中SO42-浓度,将Ca2+转化为沉淀或抑制Fe2+水解;CaSO4;
(2)为避免引入新杂质,应加入过氧化氢为氧化剂,还原产物是水,反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O,故答案为:b;
(3)在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵,温度不能过高,防止分解,
故答案为:冷却结晶;常温晾晒;
(4)硫酸铁铵中铵根离子、铁离子易水解,应该在硫酸环境下来蒸发,故答案为:硫酸铁铵溶液蒸发应该在酸性环境中进行,防止铁离子水解;
(5)称取14.00g样品,将其溶于水配置成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14g沉淀,应为Fe(OH)3,
n(Fe(OH)3)=
=0.02mol,
向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42-)=0.05mol,
所以14.00g样品中含有Fe2(SO4)30.02mol,n(SO42-)为0.1mol,则(NH4)2SO4为0.1mol-0.02mol×3=0.04mol,
则m(H2O)=14.00g-0.02mol×400g/mol-0.04mol×132g/mol=0.72g,
n(H2O)=
=0.04mol,
n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,
所以化学式为Fe2(SO4)3?2(NH4)2SO4?2H2O,
故答案为:Fe2(SO4)3?2(NH4)2SO4?2H2O.
(1)加入硫酸,可增大溶液中SO42-浓度,将Ca2+转化为沉淀,生成CaSO4,同时抑制Fe2+水解,
故答案为:增大溶液中SO42-浓度,将Ca2+转化为沉淀或抑制Fe2+水解;CaSO4;
(2)为避免引入新杂质,应加入过氧化氢为氧化剂,还原产物是水,反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O,故答案为:b;
(3)在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵,温度不能过高,防止分解,
故答案为:冷却结晶;常温晾晒;
(4)硫酸铁铵中铵根离子、铁离子易水解,应该在硫酸环境下来蒸发,故答案为:硫酸铁铵溶液蒸发应该在酸性环境中进行,防止铁离子水解;
(5)称取14.00g样品,将其溶于水配置成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14g沉淀,应为Fe(OH)3,
n(Fe(OH)3)=
| 2.14g |
| 107g/mol |
向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42-)=0.05mol,
所以14.00g样品中含有Fe2(SO4)30.02mol,n(SO42-)为0.1mol,则(NH4)2SO4为0.1mol-0.02mol×3=0.04mol,
则m(H2O)=14.00g-0.02mol×400g/mol-0.04mol×132g/mol=0.72g,
n(H2O)=
| 0.72g |
| 18g/mol |
n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,
所以化学式为Fe2(SO4)3?2(NH4)2SO4?2H2O,
故答案为:Fe2(SO4)3?2(NH4)2SO4?2H2O.
点评:本题考查考查物质的分离、提纯制备,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,注意根据物质的性质把握实验原理和方法,难度较大.

练习册系列答案
相关题目
下列物质的体积最大的是( )
| A、标况下,0.3 mol的NH3 |
| B、4℃时,18克水 |
| C、2mol的Al (密度为2.7g/cm3 ) |
| D、100g 37% 密度1.20 g/cm3 NaCl 溶液 |
下列物质属于酸性氧化物的是( )
| A、Na2O |
| B、CO |
| C、CaO |
| D、SO2 |
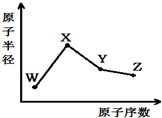 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强.



