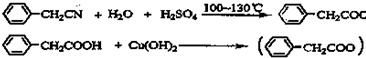题目内容
1.下列说法正确的是( )| A. | 合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 | |
| B. | 常温下,用蒸馏水不断稀释醋酸,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值变小 | |
| C. | 反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | |
| D. | 对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
分析 A.催化剂不影响平衡移动;
B.用蒸馏水不断稀释醋酸,电离平衡正向移动,醋酸的物质的量减小,醋酸根离子的物质的量增大;
C.△H-T•△S<0的反应可自发进行;
D.Ca(OH)2的溶解度随温度的升高而降低.
解答 解:A.催化剂能加快反应速率,不能影响化学平衡,故A错误;
B.稀释醋酸,醋酸的电离平衡向右移动,所以溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大,故B错误;
C.反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,说明△H-T•△S<0,该反应的△S>0,则△H的正负不能确定,故C错误;
D.温度升高,Ca(OH)2的溶解速率增大,Ca(OH)2的溶解度减小,则Ksp减小,故D正确;
故选D.
点评 本题考查化学反应的方向的判断、电离平衡、催化剂、沉淀溶解平衡等,为高频考点,把握平衡移动原理的应用、反应进行方向的判断、溶解平衡为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的难点,题目难度不大.

练习册系列答案
 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
11.实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定氢氧化钠的质量分数约为82%,为了验证其纯度,用浓度为0.1mol•L-1的盐酸进行滴定,完成下列问题:
(1)称取5.0g该氢氧化钠固体样品,配成500mL溶液备用;
(2)将标准盐酸装在酸式滴定管中,调节液面位置在“0”刻度以下,并记录下刻度;
(3)取25.00mL待测液.该项实验操作使用的主要仪器有(除锥形瓶外)碱式滴定管,用酚酞作指示剂时,滴定到溶液颜色由红色刚好变成无色为止;
(4)某同学根据三次实验分别记录有关数据如下表:
请选用其中合理数据列出氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)=0.1044mol/L.
(5)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是CD(填写编号)
A.中和滴定达终点时俯视滴定管内液面度数
B.碱式滴定管用蒸馏水洗净后立即取用25ml待测碱溶液注入锥形瓶进行滴定
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定.
(1)称取5.0g该氢氧化钠固体样品,配成500mL溶液备用;
(2)将标准盐酸装在酸式滴定管中,调节液面位置在“0”刻度以下,并记录下刻度;
(3)取25.00mL待测液.该项实验操作使用的主要仪器有(除锥形瓶外)碱式滴定管,用酚酞作指示剂时,滴定到溶液颜色由红色刚好变成无色为止;
(4)某同学根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(5)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是CD(填写编号)
A.中和滴定达终点时俯视滴定管内液面度数
B.碱式滴定管用蒸馏水洗净后立即取用25ml待测碱溶液注入锥形瓶进行滴定
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定.
13.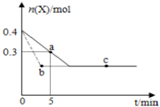 在恒温2L密闭容器中通入气体X并发生反应:2X(g)═Y(g)△H<0,X的物质的量n(x)随时间t变化的曲线如图所示(图中的两曲线分别代表有无催化剂的情形),下列叙述正确的是( )
在恒温2L密闭容器中通入气体X并发生反应:2X(g)═Y(g)△H<0,X的物质的量n(x)随时间t变化的曲线如图所示(图中的两曲线分别代表有无催化剂的情形),下列叙述正确的是( )
 在恒温2L密闭容器中通入气体X并发生反应:2X(g)═Y(g)△H<0,X的物质的量n(x)随时间t变化的曲线如图所示(图中的两曲线分别代表有无催化剂的情形),下列叙述正确的是( )
在恒温2L密闭容器中通入气体X并发生反应:2X(g)═Y(g)△H<0,X的物质的量n(x)随时间t变化的曲线如图所示(图中的两曲线分别代表有无催化剂的情形),下列叙述正确的是( )| A. | 实线表示使用催化剂的情形 | |
| B. | b、c两点表明反应在相应条件下达到了最大限度 | |
| C. | 反应从开始到a点的平均反应速率可表示为v(Y)=0.01mol/(L•min) | |
| D. | 反应进行到a点时放出的热量大于反应进行到b点时放出的热量 |
10.下列有关说法正确的是( )
| A. | NH4Cl(s)═NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反 | |
| C. | 对于N2(g)+3H2(g)?2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大 | |
| D. | 25℃时NH3•H2O稀溶液中,加水稀释$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{H}_{4}^{+})}$的值增大 |
11. 在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol,有关数据及特定平衡状态见表.
在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol,有关数据及特定平衡状态见表.
(1)若平衡后同种物质的体积分数相同,起始时乙容器通入的N2的物质的量为1.6mol,
起始时乙中的压强是甲容器的0.8倍,乙的平衡常数为107(mol/L)-2
(2)恒容密闭容器中可以发生氨气的分解反应,达平衡后,仅改变下表中反应条件x,下列各项中y随x的增大而增大的是bc(选填序号).
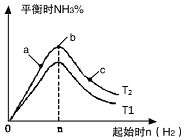
(3)研究在其他条件不变时,改变起始物氢气的物质的量对反应的影响,实验结果如图所示(图中T表示温度,n表示物质的量):
①像中T2和T1的关系是:T2低于T1(填“高于”“低于”“等于”“无法确定”).
②a、b、c三点中,N2转化率最高的是c(填字母).
③若容器容积为1L,T2℃在起始体系中加入1mol N2,3molH2,经过5min反应达到平衡时H2的转化率为60%,则NH3的反应速率为0.24mol.L-1.min-1.保持容器体积不变,若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q>110.88kJ(填“>”、“<”或“=”).
 在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol,有关数据及特定平衡状态见表.
在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol,有关数据及特定平衡状态见表.| 容器 | 起始投入 | 达平衡时 | |||
| 甲 | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 | |
| 乙 | amolN2 | bmolH2 | 0molNH3] | 1.2molNH3 | |
起始时乙中的压强是甲容器的0.8倍,乙的平衡常数为107(mol/L)-2
(2)恒容密闭容器中可以发生氨气的分解反应,达平衡后,仅改变下表中反应条件x,下列各项中y随x的增大而增大的是bc(选填序号).
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入氨气的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时氨气的转化率 |
①像中T2和T1的关系是:T2低于T1(填“高于”“低于”“等于”“无法确定”).
②a、b、c三点中,N2转化率最高的是c(填字母).
③若容器容积为1L,T2℃在起始体系中加入1mol N2,3molH2,经过5min反应达到平衡时H2的转化率为60%,则NH3的反应速率为0.24mol.L-1.min-1.保持容器体积不变,若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q>110.88kJ(填“>”、“<”或“=”).
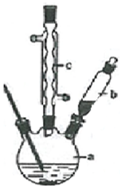 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: