题目内容
1. (1)对于反应:K2Cr2O7+HCl→KCl+CrCl3+Cl2↑+H2O,回答下列问题:
(1)对于反应:K2Cr2O7+HCl→KCl+CrCl3+Cl2↑+H2O,回答下列问题:①配平方程式,并用单线桥表示此反应转移的电子数目及方向
1K2Cr2O7+14HCl=2KCl+2 CrCl3+3Cl2↑+7H2O
②若反应中,发生氧化反应的HCl为1.2mol,则被还原的K2Cr2O7物质的量为0.2mol.
(2)工业合成氨的反应:N2+3H2$?_{催化剂}^{高温、高压}$2NH3是一个可逆反应,在容积为2L的密闭容器中进行,反应经过10min后,生成10mol NH3,则用N2表示的化学反应速率是0.25mol,•(L•min)-1;如果将1mol N2和3mol H2混合,在一定条件下使其充分反应,反应放出的热量总小于上述数值,其原因是
该反应是可逆反应,1 mol N2和3 mol H2不能完全反应,因此放出的热量总是小于92 kJ.
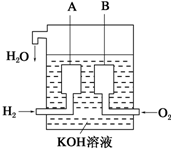
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极均由多孔的碳块组成.该电池的正极反应式为:O2+2H2O+4e-═4OH-.如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电池装置,电池的总反应方程式为:CH4+2O2+2KOH═K2CO3+3H2O,则该电池的负极反应式为:CH4+8e-+10OH-=CO32-+7H2O.
分析 (1)①该反应中,Cr元素化合价由+6价变为+3价、Cl元素化合价由-1价变为0价;根据化合价升高值=化合价降低值=转移电子数来回答;
②根据发生氧化反应的HCl和K2Cr2O7的关系式计算;
(2)根据v=$\frac{△c}{△t}$来计算速率;不同物质表示的速率之比等于系数之比,据此计算;
(3)在燃料电池中,通入正极的一极氧气,通入负极的一极氧气是燃料,负极的电极反应=总反应-正极的电极反应.
解答 解:(1)①反应中所有Cr元素化合价降低了6价,被还原,K2Cr2O7具有氧化性,为氧化剂,部分Cl元素的化合价从-1升高到了0价,共升高了6价,根据电子守恒,所以重铬酸钾的系数是1,CrCl3的系数是2,氯气的系数是3,根据K元素守恒,KCl的系数是2,根据Cl元素守恒,HCl的系数是14,根据H元素守恒,生成的水的系数是7,转移电子数目为6,用单线桥法标出电子转移的方向和数目可表示为 ,
,
故答案为:1;14;2;2;3;7; ;
;
②若反应中,假设有14molHCl参加反应,有6molHCl被氧化,所以发生氧化反应的HCl为1.2mol,则被还原的K2Cr2O7物质的量=$\frac{1.2mol}{6}$=0.2mol,
故答案为:0.2;
(2)在容积为2L的密闭容器中进行,反应经过10min后,生成10mol NH3,则用NH3表示的化学反应速率是$\frac{\frac{10mol}{2L}}{10min}$=0.5mol•(L•min)-1,用氮气表示的速率是氨气表示速率的一半,即用N2表示的化学反应速率是0.25,mol•(L•min)-1,该反应是可逆反应,1 mol N2和3 mol H2不能完全反应,因此放出的热量总是小于92 kJ;
故答案为:0.25;该反应是可逆反应,1 mol N2和3 mol H2不能完全反应,因此放出的热量总是小于92 kJ;
(3)燃料电池的总反应离子方程式为:CH4+2O2+2OH-=CO32-+3H2O,正极上通的是氧气,电极反应:O2+2H2O+4e-═4OH-,负极一定是燃料失电子的过程,因正极和负极相加即为总反应,所以:CH4+8e-+10OH-=CO32-+7H2O,
故答案为:O2+2H2O+4e-═4OH-;CH4+8e-+10OH-=CO32-+7H2O.
点评 本题考查原电池工作原理、氧化还原反应的计算、化学反应速率的计算知识,可以根据所学知识进行回答,难度不大.需要注意的是电解质溶液的酸碱性不同,电极反应不同.

| A. | 干冰、液态氯化氢都是电解质 | |
| B. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| C. | NaOH晶体中既含有离子键又含有共价键 | |
| D. | Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 |
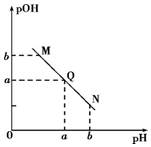
| A. | N点处pH>pOH,则N点处所示溶液呈酸性 | |
| B. | 该温度下水的离子积Kw=1×10-2a | |
| C. | Q点所示溶液呈中性,则M、N、Q三点中只有Q点溶液中水的电离出的c(H+)与水的电离c(OH-)相等 | |
| D. | M点所示溶液的导电能力强于Q |
| A. | 水和四氯化碳可以用分液漏斗进行分离 | |
| B. | 提取溴水中的溴单质,可以用四氯化碳进行萃取 | |
| C. | 可以用高温加热的方法除去CaO中混有的CaCO3 | |
| D. | 可以用蒸发结晶的方法除去KNO3固体中混有的少量NaCl |
| A. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| B. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4的混合溶液中,先产生Ag2CrO4沉淀 | |
| C. | c(Mg2+)为0.11 mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
| A. | Na在空气中燃烧,发出黄色火焰 | B. | Na在空气中燃烧,产物是Na2O | ||
| C. | Na是银白色金属,硬度小,熔点低 | D. | Na、K合金可作原子反应堆的导热剂 |
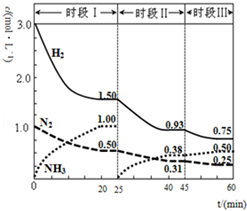 N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图.
N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图.