题目内容
13.常温时,Ksp[Mg(OH)2]=1.1×10-11,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12Ksp(CH3COOAg)=2.3×10-3,下列叙述不正确的是( )| A. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| B. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4的混合溶液中,先产生Ag2CrO4沉淀 | |
| C. | c(Mg2+)为0.11 mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
分析 A.根据Ksp(CH3COOAg)=c(CH3COO-)×c(Ag+)计算;
B.根据Ksp(AgCl)以及Ksp(Ag2CrO4)计算生成沉淀时银离子的浓度,根据银离子浓度判断;
C.根据Ksp〔Mg(OH)2〕=c(Mg2+)×c2(OH-)计算;
D.Ksp(AgCl)只受温度的影响.
解答 解:A.等体积混合浓度均为0.1mol•L-1,c(CH3COO-)×c(Ag+)=0.01>2.3×10-3,一定产生CH3COOAg沉淀,故A正确;
B.0.001 mol•L-1的KCl溶液中形成AgCl沉淀时,银离子的浓度为c(Ag+)=$\frac{1.8×1{0}^{-10}}{0.001}$=1.8×10-7mol/L,0.001 mol•L-1的K2CrO4溶液中形成Ag2CrO4沉淀时,c(Ag+)=$\sqrt{\frac{1.9×1{0}^{-12}}{0.001}}$=$\sqrt{19}$×10-5mol/L,则KCl溶液中形成AgCl沉淀时银离子浓度小,即AgCl先达到饱和,应先生成AgCl沉淀,故B错误;
C.Ksp〔Mg(OH)2〕=c(Mg2+)×c2(OH-),c(OH-)≥$\sqrt{\frac{1.1×1{0}^{-11}}{0.11}}$=10-5 mol•L-1,溶液的pH至少要控制在9以上,故C正确;
D.Ksp(AgCl)只受温度的影响,与浓度无关,所以在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变,故D正确;
故选B.
点评 本题综合考查难溶电解质的溶解平衡,为高频考点,侧重于学生的分析、计算能力的考查,题目难度中等,注意把握计算公式的应用.

练习册系列答案
相关题目
11.2016年里约奥运会已经圆满结束,其中各种各样的材料为奥运会成功举办起到了举足轻重的作用.下列有关奥运材料的说法错误的是( )
| A. | 火炬燃料丙烷充分燃烧后只生成二氧化碳和水 | |
| B. | 撑杆跳高运动员使用的碳纤维撑杆属于有机高分子材料 | |
| C. | 泳池中加入的适量漂白粉可起到杀菌消毒作用 | |
| D. | 举重和体操运动员手上涂抹的碳酸镁白色粉末可吸水防滑 |
8.某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(以下数据和实验均指在25℃下测定)实验步骤如下:
①往100mL 0.1mol•L-1的CaCl2溶液中加入100mL 0.1mol•L-1的Na2SO4溶液,立即有白色沉淀生成.
②向上述悬浊液中加入足量Na2CO3固体,搅拌,静置,沉淀后弃去上层清液.
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液.
④_______.
(1)步骤①所得悬浊液中c(Ca2+)=0.003 mol•L-1
(2)写出第②步发生反应的离子方程式:CO32-(aq)+CaSO4(s)=SO42-(aq)+CaCO3(s).
(3)请补充第④步操作及发生的现象加入盐酸,沉淀完全溶解,有气泡冒出.
(4)请写出该原理在实际生产生活中的一个应用用于除去锅垢:
| 难溶电解质 | CaCO3 | CaSO4 |
| Ksp | 2.8×10-9 | 9×10-6 |
②向上述悬浊液中加入足量Na2CO3固体,搅拌,静置,沉淀后弃去上层清液.
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液.
④_______.
(1)步骤①所得悬浊液中c(Ca2+)=0.003 mol•L-1
(2)写出第②步发生反应的离子方程式:CO32-(aq)+CaSO4(s)=SO42-(aq)+CaCO3(s).
(3)请补充第④步操作及发生的现象加入盐酸,沉淀完全溶解,有气泡冒出.
(4)请写出该原理在实际生产生活中的一个应用用于除去锅垢:
18.某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )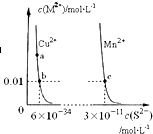

| A. | a点对应的 Ksp大于b点对应的Ksp | |
| B. | 向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)═CuS(s)+Mn2+(aq) | |
| C. | 在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)=2×10-23:1 | |
| D. | 该温度下,Ksp(CuS)小于Ksp(MnS) |
5.在固定容积的密闭容器中,放入amolX,发生反应:2X?Y(g)+Z(s),并达到平衡状态,此时升高温度,气体的密度增大.下列叙述正确的是( )
| A. | 平衡后移走部分Z,平衡正向移动 | |
| B. | 若正反应为放热反应,则X一定为气态 | |
| C. | 若X为非气态,则正反应为放热反应 | |
| D. | 若X为气态,再向容器中充入amolX,达到平衡后,X的体积分数增大 |

 (1)对于反应:K2Cr2O7+HCl→KCl+CrCl3+Cl2↑+H2O,回答下列问题:
(1)对于反应:K2Cr2O7+HCl→KCl+CrCl3+Cl2↑+H2O,回答下列问题: