题目内容
16. 已知:①抗坏血酸(C6H8O6)(Vc)溶于水和乙醇,具有抗氧化性,可使酸性高锰酸钾溶液褪色;
已知:①抗坏血酸(C6H8O6)(Vc)溶于水和乙醇,具有抗氧化性,可使酸性高锰酸钾溶液褪色;②磷酸亚铁[Fe3(PO4)2•8H2O]为白蓝色单斜晶体,溶于稀酸,不溶于水、乙醇、醋酸.
I.磷酸亚铁是生产LiFePO4电池的原料,实验室利用FeSO4•7H2O、Na2HPO4•12H2O及CH3COONa•3H2O为原料制备磷酸亚铁晶体,合成时的主要反应为:
3FeSO4+2Na2HPO4+2CH3COONa+8H2O=Fe3(PO4)2•8H2O↓+3Na2SO4+2CH3COOH
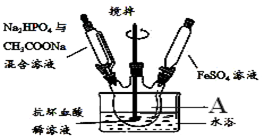
装置如图所示:
实验步骤:
①在50mL干净的仪器A中加入抗坏血酸(C6H8O6)稀溶液作底液;
②滴入足量Na2HPO4与CH3COONa混合溶液至pH=4;
③滴入含15.2g克FeSO4的溶液,最终维持pH=6,充分反应后静置;
④进行过滤和操作b,低温烘干得到磷酸亚铁晶体12.8克.
请回答下列问题:
(1)仪器A的名称是三颈烧瓶;
(2)配制FeSO4溶液时所用的蒸馏水应先进行的操作是煮沸除去水中的溶解的氧气.
(3)步骤④操作b的名称是洗涤,检验操作b是否完全的方法是取最后一次洗涤滤出液1-2mL于试管,滴入BaCl2溶液,若无白色沉淀,说明洗涤干净.
(4)抗坏血酸溶液的作用是防止磷酸亚铁被氧化.
(5)本实验的产率是76.5%(M[Fe3(PO4)2•8H2O]=502g•mol-1).
Ⅱ.水果和蔬菜中含有丰富的Vc,某研究性学习小组对它探究如下:
探究一:测定果汁中Vc的含量
分别向盛有lmL等浓度高锰酸钾稀溶液的四只试管中逐滴滴加梨汁、橙汁、苹果汁和0.04%的Vc溶液,边滴边振荡,直至高锰酸钾溶液褪色,测得以下数据:
| 梨汁 | 苹果汁 | 橙汁 | 0.04%的Vc溶液 | |
| 滴加的滴数 | 40 | 20 | 10 | 5 |
探究二:蔬菜放置时间的长短对其Vc含量是否有影响
(7)请你用新鲜的西红柿、放置一周的西红柿、高锰酸钾稀溶液和必要的仪器设计实验方案:将新鲜西红柿和放置一周的西红柿分别捣碎,用纱布将汁液分别挤入两个烧杯中,向取有等量高锰酸钾稀溶液的两支试管中,分别滴入上述两种西红柿汁,边滴边振荡,直到高锰酸钾溶液刚好褪色,记录滴数..
分析 I.(1)由仪器结构可知,仪器A为三颈烧瓶;
(2)防止Fe2+离子被氧化,蒸馏水事先要煮沸除去溶液中的溶解的氧气;
(3)步骤是分离不溶的固体与液体得到磷酸亚铁粗产品,需要采取过滤、洗涤等;检验最后一次洗涤液是否含有硫酸根离子判断洗涤是否完全;
(4)抗坏血酸具有抗氧化性,+2价Fe易被氧化;
(5)根据Fe原子守恒计算Fe3(PO4)2•8H2O的理论产量,进而计算产率;
Ⅱ.(6)水果和蔬菜中含有丰富的Vc会被酸性高锰酸钾溶液氧化,酸性高锰酸钾溶液体积一定,加入溶液体积越少说明Vc的含量越高,结合加入5滴0.04%的Vc溶液可以使酸性高锰酸钾溶液褪色计算;
(7)取等量的两种西红柿的汁滴加高锰酸钾溶液,记录下溶液无色时所滴入瓜汁的滴数.
解答 解:(1)由仪器结构特征,可知仪器A为三颈烧瓶,
故答案为:三颈烧瓶;
(2)Fe2+具有强还原性,防止Fe2+离子被氧化,蒸馏水事先要煮沸、冷却,可以除去水中的溶解的氧气,故答案为:煮沸除去水中的溶解的氧气;
(3)步骤是分离不溶的固体与液体得到磷酸亚铁粗产品,过滤后进行洗涤,操作b的名称是洗涤,产品表面会附着硫酸根,取最后一次洗涤滤出液1-2mL于试管,滴入BaCl2溶液,若无白色沉淀,说明洗涤干净,
故答案为:洗涤;取最后一次洗涤滤出液1-2mL于试管,滴入BaCl2溶液,若无白色沉淀,说明洗涤干净;
(4)抗坏血酸具有抗氧化性,+2价Fe易被氧化,抗坏血酸溶液的作用是:防止磷酸亚铁被氧化,
故答案为:防止磷酸亚铁被氧化;
(5)15.2gFeSO4的物质的量为$\frac{15.2g}{152g/mol}$=0.1mol,根据Fe元素守恒,理论上得到Fe3(PO4)2•8H2O的质量为0.1mol×$\frac{1}{3}$×502g/mol=16.73g,磷酸亚铁产率是$\frac{12.8g}{16.73g}$×100%=76.5%,
故答案为:76.5%;
Ⅱ.(6)Vc能使高锰酸钾溶液褪色,三种水果饮料中,橙汁只滴入10滴溶液即呈无色,而其它两种则分别需要滴入40滴和20滴,故橙汁中Vc含量最高,而0.04%的标准Vc溶液滴入5滴后溶液为无色,可知橙汁中Vc含量为标准溶液的一半,即橙汁中Vc含量为0.02%,
故答案为:橙汁;0.02%;
(7)将新鲜西红柿和放置一周的西红柿分别捣碎,用纱布将汁液分别挤入两个烧杯中,向取有等量高锰酸钾稀溶液的两支试管中,分别滴入上述两种西红柿汁,边滴边振荡,直到高锰酸钾溶液刚好褪色,记录滴数,比较判断,
故答案为:将新鲜西红柿和放置一周的西红柿分别捣碎,用纱布将汁液分别挤入两个烧杯中,向取有等量高锰酸钾稀溶液的两支试管中,分别滴入上述两种西红柿汁,边滴边振荡,直到高锰酸钾溶液刚好褪色,记录滴数.
点评 本题考查物质制备实验方案、探究实验,涉及对仪器识别、物质的分离提纯、对操作的分析评价、实验方案设计、产率计算等,较好的考查学生信息获取与知识迁移运用能力,题目难度中等.

| A. | H2O2的电子式: | B. | 次氯酸的结构式:H-O-Cl | ||
| C. | S2-的结构示意图: | D. | CO2的比例模型: |
| A. | 甲烷与氯气混和后光照反应;乙烯使酸性高锰酸钾溶液的褪色 | |
| B. | 乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯与浓硝酸和浓硫酸的混合液反应生成油状液体;乙烯与水生成乙醇的反应 | |
| D. | 乙烯与溴水反应;乙酸与乙醇的酯化反应 |
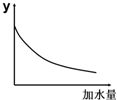
| A. | 溶液的pH | B. | 溶液的导电能力 | ||
| C. | 醋酸的电离平衡常数 | D. | 醋酸的c (OH-) |
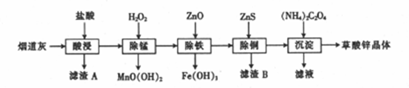
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 1.9 | 6.5 | 4.2 | 5.4 |
| 完全沉淀时的pH | 3.3 | 9.7 | 6.7 | 8.2 |
(1)滤渣A的主要成分为SiO2(填化学式).
(2)生成滤渣B的离子方程式为ZnS+Cu2+=CuS+Zn2+.
(3)除铁时加入ZnO控制反应液的pH范围为3.3~5.4.
(4)该炼锌厂废气中含有H2S,可用FeCl3溶液吸收H2S,得到单质硫,过滤后,再以石墨为电极,在一定条件下电解滤液.
①FeCl3与H2S反应的离子方程式为2Fe3++H2S=2Fe2++S↓+2H+.
②电解池中阴极的电极反应式为2H+-2e-=H2↑.
(5)25℃时,向0.10mol•L-1的H2S溶液中通入HCl气体或加入NaOH固体以调节溶液pH与c(S2-)的关系如图2所示(忽略溶液体积的变化和H2S的挥发)
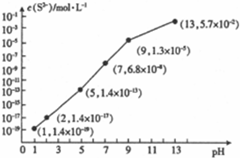
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1
②某溶液中含未知浓度的Mn2+、0.01mol•L-1Fe2+和0.10mol•L-1H2S,当溶液pH=2时,Fe2+ 开始沉淀,当Mn2+开始沉淀时,溶液中
$\frac{c(M{n}^{2+})}{c(F{e}^{2+})}$=2×106.
| A. | 向碘化钾溶液中加入用硫酸酸化的过氧化氢溶液:2I-+H2O2═I2+2OH- | |
| B. | 在亚硫酸中加入过量的次氯酸钠溶液:H2SO3+ClO-═Cl-+2H++SO42- | |
| C. | 向Ba(OH)2溶液中加入过量NH4HSO4:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | Fe2O3溶于过量的氢碘酸中:Fe2O3+6H+═2Fe3++3H2O |

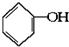 合成
合成 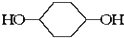 .(部分试剂和反应条件已略去)已知D为1,3-环己二稀
.(部分试剂和反应条件已略去)已知D为1,3-环己二稀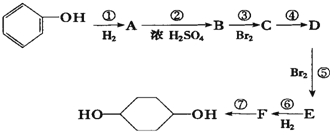

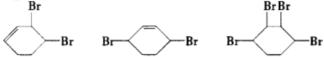 .
.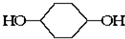 的一种同分异构体可发生银镜反应,也可以水解,核磁共振氢谱显示有三个峰,其面积比为1:2:9,该同分异构体的结构简式为HCOOCH2C(CH3)3
的一种同分异构体可发生银镜反应,也可以水解,核磁共振氢谱显示有三个峰,其面积比为1:2:9,该同分异构体的结构简式为HCOOCH2C(CH3)3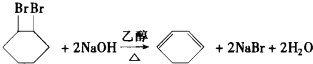 (有机物写结构简式,并注明反应条件)
(有机物写结构简式,并注明反应条件)