题目内容
1.下列各项中,不能运用化学平衡移动原理解释的是( )| A. | 实验室中用饱和食盐水除去氯气中的氯化氢气体 | |
| B. | 实验室中久置的浓氨水碱性减弱 | |
| C. | 向硝酸亚铁溶液中滴加盐酸,溶液变为黄色 | |
| D. | 在较高温度下测定二氧化氮气体相对分子质量 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A、氯气和水反应生成氯化氢和次氯酸是化学平衡,饱和食盐水中氯离子浓度大,减小氯气的溶解度,收集氯气用排饱和食盐水的方法,能用化学平衡移动原理解释,故A不符合;
B、浓氨水分解产生氨气导致,氨水的电离平衡向生成一水合氨方向移动,能用化学平衡移动原理解释,故B不符合;
C、向硝酸亚铁溶液中滴加盐酸,溶液变为黄色,是因为亚铁离子、氢离子和硝酸根离子之间发生氧化还原生成铁离子而呈黄色,不能用化学平衡移动原理解释,故C符合;
D、2NO2?N2O4 △H<0在较高温度下,平衡向生成二氧化氮方向移动,能用化学平衡移动原理解释,故D不符合;
故选C.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
12. 短周期主族元素W、X、Y、Z的原子序数依次增加.K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一.0.05mol/L丙溶液的pH为1,上述物质的转化关系如图所示.
短周期主族元素W、X、Y、Z的原子序数依次增加.K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一.0.05mol/L丙溶液的pH为1,上述物质的转化关系如图所示.
下列说法正确的是( )
 短周期主族元素W、X、Y、Z的原子序数依次增加.K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一.0.05mol/L丙溶液的pH为1,上述物质的转化关系如图所示.
短周期主族元素W、X、Y、Z的原子序数依次增加.K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一.0.05mol/L丙溶液的pH为1,上述物质的转化关系如图所示.下列说法正确的是( )
| A. | 丙也可由W、Y组成的某种化合物与K直接反应制得 | |
| B. | K、L、M 中沸点最高的是M | |
| C. | 原子半径:W<X<Y | |
| D. | 元素的非金属性:Z>Y>X |
13.依据下列事实所得出的结论或推测正确的是( )
| 事实 | 结论或推测 | |
| A | Na与冷水激烈反应,生成H2 | Mg与沸水迅速反应,生成H2 |
| B | F2与H2暗处剧烈化合,生成的HF很稳定 | I2与H2加热也能化合,生成的HI也很稳定 |
| C | Na与O2加热反应生成Na2O2 | IA元素单质与O2加热反应均生成过氧化物 |
| D | H3PO4是中强酸,As是P的同主族非金属元素 | H3AsO4是强酸 |
| A. | A | B. | B | C. | C | D. | D |
16.下列实验操作正确的是( )
| A. | 取用粉末状固体或固体小颗粒时,应用药匙或纸槽,取用块状固体时,应用镊子夹取 | |
| B. | 取用细口瓶里的试液时,先拿下瓶塞,倒放在桌上,然后标签朝外拿起瓶子,瓶口要紧挨着试管口,将液体缓缓地倒入试管 | |
| C. | 胶头滴管取完一种试液后,可直接取另一种不与其反应的试液 | |
| D. | 当某实验没有准确的药品用量说明时,为看到明显现象,取用药品越多越好 |
10.设NA为阿伏加德罗常数,下列有关叙述正确的是( )
| A. | 1 molN2与4 mol H2在一定条件下反应生成NH3的分子数为2NA | |
| B. | 标准状况下,5.6LSO3中含有的原子总数为NA | |
| C. | 1 molCu和足量的硫粉加热反应转移的电子数是2NA | |
| D. | 常温下,4.6g NO2 和N2O4的混合物中氧原子数为0.2NA |
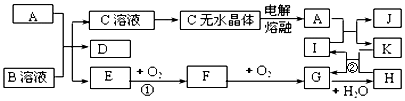
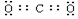 .
.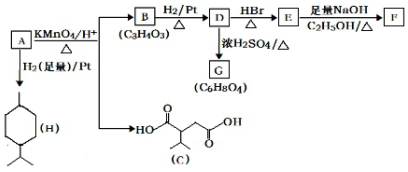
 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$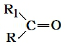 +R2COOH
+R2COOH .
. .
.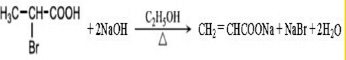 .
.