题目内容
在一个固定体积的密闭容器中,加入2molA和1molB,发生反应:2A(g)+B(g)?C(g)+D(g)达到平衡时.C的浓度为Wmol?L-1,若维持容器体积和温度不变,用下列物质作为起始反应物时,经反应达到平衡后C的浓度(填“大于”、“等于”、“小于”或“无法确定”).
(1)加入1molA和1molB时,C的平衡浓度 W mol?L-1.
(2)加入2molA、1molB、1molC、1molD时,C的平衡浓度 2Wmol?L-1.
(1)加入1molA和1molB时,C的平衡浓度
(2)加入2molA、1molB、1molC、1molD时,C的平衡浓度
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)固定容积的容器中,气体压强与气体的物质的量成正比,减小压强,平衡向气体体积增大的方向移动;
(2)将C和D换算为A和B,再根据容器中A和B的量与第一次相比判断C的浓度.
(2)将C和D换算为A和B,再根据容器中A和B的量与第一次相比判断C的浓度.
解答:
解:(1)若维持容器的体积和温度不变,加入1mol A和1mol B时,与第一次相比,A的物质的量减少,则容器内压强小于第一次,减小压强平衡向逆反应方向移动,则B的转化率减小,所以C的浓度<W mol?L-1,
故答案为:小于;
(2)若维持容器的体积和温度不变,加入2molA、1molB、1molC、1molD时,将C和D换算为A和B时,容器内A和B的物质的量分别是4mol、2mol,刚好是开始的2倍,如果平衡等效,则C的浓度=2W mol?L-1,又因容器的压强增大,平衡向正反应方向移动,则平衡时C的浓度>2W mol?L-1,
故答案为:大于.
故答案为:小于;
(2)若维持容器的体积和温度不变,加入2molA、1molB、1molC、1molD时,将C和D换算为A和B时,容器内A和B的物质的量分别是4mol、2mol,刚好是开始的2倍,如果平衡等效,则C的浓度=2W mol?L-1,又因容器的压强增大,平衡向正反应方向移动,则平衡时C的浓度>2W mol?L-1,
故答案为:大于.
点评:本题考查了化学平衡的有关知识,明确等效平衡及压强对该反应的影响是解本题关键,难度中等.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
下列叙述正确的是( )
| A、白铁(镀锌)的表面一量破损,铁腐蚀加快 |
| B、原电池中电子向负极流动 |
| C、马口铁(镀锡)的表面一旦破损,铁腐蚀加快 |
| D、用铝质铆钉接铁板,铁易被腐蚀 |
下列离子在溶液中能大量共存的是( )
| A、K+ H+ Fe2+ NO3- |
| B、H+ Al3+ SO42- Cl- |
| C、Na+ Al3+ HCO3- Cl- |
| D、Na+ NH4+ OH- CO32- |
某原电池的总反应离子方程为Fe+Cu2+=Fe2++Cu不能实现该反应的原电池是( )
| A、正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 |
| B、正极为C,负极为Fe,电解质溶液为CuSO4溶液 |
| C、正极为Pt,负极为Fe,电解质溶液为CuSO4溶液 |
| D、正极为Ag,负极为Fe,电解质溶液为CuSO4溶液 |
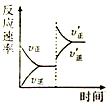 一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g)?pC(g)+qD(s),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )
一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g)?pC(g)+qD(s),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )| A、正反应是放热反应 |
| B、逆反应是放热反应 |
| C、m+n<p+q |
| D、m+n>p+q |