题目内容
高纯度氧化铝有广泛的用途,某研究小组研究用以下流程制取高纯度氧化铝:
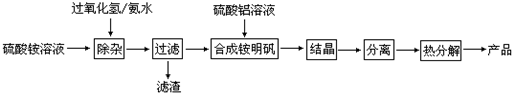
根据上述流程图回答下列问题:
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+.写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式: .
(2)检验上述流程中“过滤”后杂质是否除尽的实验方法是 .
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 .
(4)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水).母液不能蒸干的原因是 .
(5)铵明矾晶体的化学式为NH4Al(SO4)2?12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是 ,离子浓度最小的离子是 .

根据上述流程图回答下列问题:
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+.写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式:
(2)检验上述流程中“过滤”后杂质是否除尽的实验方法是
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是
(4)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水).母液不能蒸干的原因是
(5)铵明矾晶体的化学式为NH4Al(SO4)2?12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后滤液主要含硫酸铵,再将硫酸铵和硫酸铝溶液混合反应,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等最终得到硫酸铝铵晶体,硫酸铝铵晶体热分解得到氧化铝.
(1)H2O2溶液具有强氧化性,可以氧化亚铁离子生成铁离子,铁离子在氨水存在的条件下生成氢氧化铁红褐色沉淀;
(2)由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后的滤液中可能含有Fe3+,用KSCN溶液检验是否含有Fe3+;
(3)铝离子在溶液中能够发生水解生成氢氧化铝;
(4)蒸干会析出可溶性杂质的析出,且Al3+水解程度增大;
(5)根据题中所给的化学式,利用铵根和铝离子水解进行解答即可.
(1)H2O2溶液具有强氧化性,可以氧化亚铁离子生成铁离子,铁离子在氨水存在的条件下生成氢氧化铁红褐色沉淀;
(2)由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后的滤液中可能含有Fe3+,用KSCN溶液检验是否含有Fe3+;
(3)铝离子在溶液中能够发生水解生成氢氧化铝;
(4)蒸干会析出可溶性杂质的析出,且Al3+水解程度增大;
(5)根据题中所给的化学式,利用铵根和铝离子水解进行解答即可.
解答:
解:(1)H2O2溶液具有强氧化性,可以氧化亚铁离子生成铁离子,铁离子在氨水存在的条件下生成氢氧化铁红褐色沉淀,反应的离子方程式:2Fe2++H2O2+4NH3?H2O=2Fe(OH)3↓+4NH4+,
故答案为:2Fe2++H2O2+4NH3?H2O=2Fe(OH)3↓+4NH4+;
(2)由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后的滤液中可能含有Fe3+,取少许滤液于试管中,加几滴KSCN溶液,若溶液不变红色,则杂质已除尽,
故答案为:取少许滤液于试管中,加几滴KSCN溶液,若溶液不变红色,则杂质已除尽;
(3)由于铝离子在溶液中能够发生水解生成氢氧化铝,所以加入硫酸酸化,抑制了铝离子的水解,故答案为:抑制Al3+水解;
(4)由于蒸干会析出可溶性杂质的析出,且Al3+水解程度增大,所以母液不能蒸干,故答案为:减少可溶性杂质的析出及Al3+水解;
(5)铵明矾晶体的化学式为NH4Al(SO4)2?12H2O,在0.1mol/L铵明矾的水溶液中,未水解前,c(Al3+)=c(NH4+)=0.1mol/L,由于铵根和铝离子均水解,水解结合水电离出的氢氧根,故水解后浓度均小于0.1mol/L,c(SO42-)=0.2mol/L,0.2>0.1,故答案为:SO42-;OH-.
故答案为:2Fe2++H2O2+4NH3?H2O=2Fe(OH)3↓+4NH4+;
(2)由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后的滤液中可能含有Fe3+,取少许滤液于试管中,加几滴KSCN溶液,若溶液不变红色,则杂质已除尽,
故答案为:取少许滤液于试管中,加几滴KSCN溶液,若溶液不变红色,则杂质已除尽;
(3)由于铝离子在溶液中能够发生水解生成氢氧化铝,所以加入硫酸酸化,抑制了铝离子的水解,故答案为:抑制Al3+水解;
(4)由于蒸干会析出可溶性杂质的析出,且Al3+水解程度增大,所以母液不能蒸干,故答案为:减少可溶性杂质的析出及Al3+水解;
(5)铵明矾晶体的化学式为NH4Al(SO4)2?12H2O,在0.1mol/L铵明矾的水溶液中,未水解前,c(Al3+)=c(NH4+)=0.1mol/L,由于铵根和铝离子均水解,水解结合水电离出的氢氧根,故水解后浓度均小于0.1mol/L,c(SO42-)=0.2mol/L,0.2>0.1,故答案为:SO42-;OH-.
点评:本题考查工艺流程、离子检验、盐类水解、对条件的控制选择、物质的分离提纯等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案
相关题目
在25℃时,某稀溶液中由水电离产生的c(OH-)水=10-11mol/L.下列有关该溶液的叙述正确的是( )
| A、该溶液一定呈酸性 |
| B、该溶液中的c(H+)肯定等于10-3mol/L |
| C、该溶液的pH可能为3,可能为11 |
| D、该溶液一定呈碱性 |
某有机物结构简式如图,下列有关它的说法正确的是( )
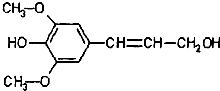

| A、分子式是C11H14O4,属于芳香烃 |
| B、分子中所有碳原子不可能在同一平面 |
| C、不能与Na反应放出H2 |
| D、能发生的反应类型有氧化、取代、加成 |
在25℃时,100ml1.0mol/L的盐酸与等体积1.2mol/L的氢氧化钠溶液混合,所得溶液的pH为( )
| A、7 | B、12 | C、13 | D、无法计算 |
在一个固定体积的密闭容器中,加入2molA和1molB发生如下反应:2A(g)+B(g)?3C(g)+D(g).达到平衡时C的浓度为Wmol/l.若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡时,C的浓度仍为Wmol/L的是( )
| A、3molC+1molD |
| B、2molA+2molC |
| C、2molA+1molB+0.5molD |
| D、1molA+0.5molB+1.5molC+0.5molD |
下列处理废水或净化水的做法不妥当的是( )
| A、在自来水中加入大量液氯进行消毒 |
| B、加入大量的明矾使浑浊的水变为澄清的水 |
| C、钢铁厂用适量熟石灰[Ca(OH)2]处理酸性废水 |
| D、加入适量S2-处理Hg2+(汞离子)污染的废水 |
氢氰酸(HCN)的下列性质中,不可以证明它是弱电解质的是( )
| A、常温下,0.01mol/L氢氰酸溶液的pH大于2 |
| B、HCN溶液用水稀释后,氢离子浓度下降 |
| C、NaCN溶液呈碱性 |
| D、相同条件下,0.01mol/L氢氰酸溶液的导电性比0.01 mol/L 氯化氢溶液的差 |
根据化学常识,下列说法正确的是( )
| A、施用碳铵(NH4HCO3)后应立即盖上土壤 |
| B、复合肥是两种或两种以上化肥的混合物 |
| C、可用工业用盐作食盐用于烹调 |
| D、三聚氰胺(C3N6H6)俗称“蛋白精”,加入到奶粉中,可提高蛋白质的含量 |