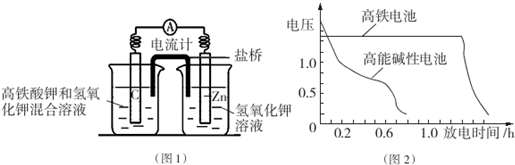
题目内容
20.标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为p g/ml,质量分数为W,物质的量浓度为c mol/L,则下列关系中不正确的是( )| A. | p=$\frac{17V+22400}{22.422.4V}$ | B. | W=$\frac{17c}{ρ}$ | ||
| C. | $\frac{17V}{17V+22400}$=W | D. | C=$\frac{1000Vρ}{17V+22400}$ |
分析 A.根据n=$\frac{V}{Vm}$计算VL氨气的物质的量,根据m=nM计算氨气的质量,根据m=ρV计算水的质量,进而计算溶液的质量,进而计算溶液的质量,根据V=$\frac{n}{C}$计算溶液的体积,由p=$\frac{m}{V}$计算溶液的密度;
B.根据c=$\frac{1000ρω}{M}$计算w,进行判断;
C.溶液质量分数=$\frac{m(氨气)}{m(氨气)+m(水)}$×100%,
D.根据n=$\frac{V}{Vm}$计算VL氨气的物质的量,根据m=nM计算氨气的质量,根据m=ρV计算水的质量,进而计算溶液的质量,进而计算溶液的质量,根据V=$\frac{m}{ρ}$计算溶液的体积,根据c=$\frac{n}{V}$计算溶液物质的量浓度.
解答 解:A.VL氨气的物质的量为$\frac{V}{22.4}$mol,氨气质量为$\frac{V}{22.4}mol×17g/mol$=$\frac{17V}{22.4}$g,1L水的质量为1000mL×1g/mL=1000g,故溶液质量为($\frac{17V}{22.4}$+1000)g,溶液体积为$\frac{\frac{V}{22.4}mol}{cmol/L}$=$\frac{V}{22.4C}$L,所以溶液的密度为p=$\frac{(\frac{17V}{22.4}+1000)g}{\frac{V}{22.4C}L}$=$\frac{17CV+22400C}{1000V}$g/mL,故A错误;
B.根据c=$\frac{1000ρω}{M}$可知,该氨水质量分数w=$\frac{17C}{1000p}$,故B错误;
C.溶液的质量分数w=$\frac{\frac{17V}{22.4}g}{(\frac{17V}{22.4}+1000)g}×100%$=$\frac{17V}{17V+22400}$×100%,故C正确;
D.溶液体积为$\frac{(\frac{17V}{22.4}+1000)g}{1000pg/L}$=$\frac{17V+22400}{22400p}$L,氨水的物质的量浓度c=$\frac{\frac{V}{22.4}mol}{\frac{17V+22400}{22400p}L}$=$\frac{1000Vp}{17V+22400}$mol/L,故D正确.
故选AB.
点评 本题考查溶液浓度有关计算,难度中等,注意对概念的理解与公式的灵活运用,注意选项A可以根据溶液体积不具备加合性判断,属于易错题目.

 名校课堂系列答案
名校课堂系列答案| A. | 氢氧化钡溶液与硫酸混合:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 铁粉与硝酸银溶液反应:Fe+2Ag+═Fe2++2Ag | |
| C. | 氯化铝溶液与过量的氨水反应:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 氯气通入冷的氢氧化钠溶液中:Cl2+2OH-═Cl-+ClO-+H2O |
| A. | 检查病人胃病所用的钡餐,只能用BaSO4,不可以用BaCO3 | |
| B. | 为了使馒头、银耳等洁白、卖相好,可以用点燃硫磺法熏蒸它们 | |
| C. | 可以用SO2来漂白纸浆、毛、丝、草帽辫等 | |
| D. | “硫磺”温泉可以医治皮肤病 |
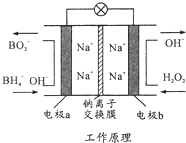 某新型电池,以NaBH4(B的化合价为+3价)和H2O2做原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池,以NaBH4(B的化合价为+3价)和H2O2做原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | 电池工作时Na+从b极区移向a极区 | |
| B. | a极上的电极反应式为BH4-+8OH--8e-=BO2- | |
| C. | b极上的电极反应式为H2O2+2e-+2H+=2H2O | |
| D. | 每消耗3molH2O2,转移3mol e- |
| A. | 碳酸氢铵和足量的氢氧化钠溶液反应:NH4++OH-=NH3↑+H2O | |
| B. | 三氯化铁溶液中通入硫化氢气体:2Fe3++H2S=2Fe2++S↓+2H+ | |
| C. | 用稀硝酸浸泡做过银镜反应的试管:Ag+2H++NO3-=Ag++NO2↑+H2O | |
| D. | 偏铝酸钠溶液中通入过量的二氧化碳气体:2AlO2-+CO2+2H2O=2Al(OH)3↓+CO32- |
| A. | 向Mg(HCO3)2溶液中加入过量的 NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-↑+2H2O | |
| B. | FeBr2溶液中通入等物质的量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | 苯酚与纯碱溶液反应:2C6H5OH+CO32-=CO2↑+H2O+2C6H5O- | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ |