题目内容
11.X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX; Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:(1)Y在元素周期表中的位置为第二周期第ⅥA族.
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),非金属气态氢化物还原性最强的是H2S(写化学式).
(3)写出实验室制备G单质的一个化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)ZX的电子式为Na+[:H]-;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
分析 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Y原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,其原子序数大于S,则G是Cl元素(不考虑稀有气体),据此进行解答.
解答 解:X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Y原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,其原子序数大于S,则G是Cl元素(不考虑稀有气体),
(1)Y是O元素,O原子有2个电子层,最外层电子数为6,处于第二周期第ⅥA族,
故答案为:第二周期第ⅥA族;
(2)非金属元素的非金属性越强,其相应的最高价含氧酸的酸性越强,这几种元素非金属性最强的是Cl元素,所以其最高价含氧酸的酸性最强的是高氯酸HClO4,
非金属性越弱,气态氢化物还原性越强,还原性最强的气态氢化物是硫化物 H2S,
故答案为:HClO4;H2S;
(3)G为Cl元素,其单质为氯气,实验室中用二氧化锰与浓盐酸加热制取氯气,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(4)ZX为NaH,NaH是离子化合物,由Na+和H-离子组成,其电子式为Na+[:H]-;NaH与水反应放出气体的化学方程式为:NaH+H2O=NaOH+H2↑,
故答案为:Na+[:H]-;NaH+H2O=NaOH+H2↑.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,能正确判断元素是解本题的关键,注意元素化合物知识和元素周期律的综合应用,试题培养了学生的灵活应用能力.

| A. | H2通入负极区 | B. | O2通入正极区 | ||
| C. | 负极反应为2H2+4OH--4e-═4H2O | D. | 正极发生氧化反应 |
| A. | 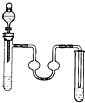 苯的溴代反应 | B. |  乙酸丁酯的制备 | C. |  苯的硝化反应 | D. |  乙炔的制取 |
| A. | 溴乙烷与氢氧化钠溶液共煮后,加入硝酸银检验Br- | |
| B. | 用CuSO4溶液除去由电石和饱和食盐水反应生成的乙炔气体中的杂质 | |
| C. | 用苯、2mol/L的硝酸和3mol/L的硫酸制硝基苯 | |
| D. | 将溴乙烷与氢氧化钠的醇溶液共热后产生的气体通入酸性高锰酸钾溶液以检验乙烯的生成 |
| A. | 滴加甲基橙试液显红色的溶液Fe3+、NH4+、SCN- | |
| B. | pH值为1的溶液Cu2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-13mol/L的溶液K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2SO4的溶液K+、HCO3-、NO3-、Al3+ |
| A. |  验证酸性:H2CO3>H2SiO3 | B. | 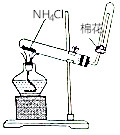 实验室制取氨气 | ||
| C. |  证明石蜡油分解生成的气体是乙烯 | D. | 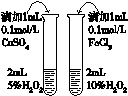 比较不同催化剂对反应速率的影响 |
| A. | H3PO3的结构为 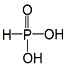 | |
| B. | H3AsO3的结构为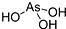 | |
| C. | H3AsO3与H3PO3一样,也为二元酸 | |
| D. | H3AsO3为三元酸,且价层电子对构型为正四面体 |
| A. | 充电时作阳极,放电时作负极 | B. | 充电时作阳极,放电时作正极 | ||
| C. | 充电时作阴极,放电时作负极 | D. | 充电时作阴极,放电时作正极 |

 .
.