题目内容
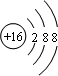
2.填空(1)画出S2-的结构示意图
 ;
;(2)用电子式表示铵根离子的结构
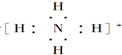 ;
;(3)在卤化氢(H-X)分子中,随着卤原子核电荷数逐渐增大,其稳定性逐渐减弱,这是由于H-X键长逐渐增大,键能逐渐减小的缘故.HCl、HBr、HI的沸点从高到低的顺序是HI、HBr、HCl,HF的沸点反常,原因是HF分子间含有氢键.
(4)由金属铜、锌和稀硫酸构成的原电池,负极上发生反应的电极反应式为:Zn-2e-═Zn2+.正极发生的反应是还原(填“氧化”或“还原”).在溶液中,阳离子的从负极向正极迁移.
(5)已知二氧化碳通入漂白粉溶液,生成白色沉淀.写出该反应的离子方程式:
CO2+Ca2++2ClO-+H2O═CaCO3↓+2HClO.
(6)已知:4gH2在O2中完全燃烧生成液态水,释放出热量为571.6kJ.试写出该反应的热化学方程式2H2(g)+O2(g)=H2O(l)△H=-571.6KJ/mol.
分析 (1)S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,用小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数;
(2)铵根离子中4个氢原子与氮原子个共用1对电子;
(3)同主族从上到下随着卤原子核电荷数逐渐增大,氢化物的稳定性逐渐减弱,原子半径依次增大,H-X键长增大,键能减小,结构相似的分子晶体,熔沸点与式量成正比,HF分子间含有氢键沸点较高;
(4)锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,铜为正极,正极上氢离子得电子发生还原反应,电子从负极流向正极,阳离子从负极移向正极,以此解答;
(5)漂白粉的主要成分为氯化钙和次氯酸钙,有效成分为次氯酸钙,次氯酸钙易与空气中水、二氧化碳反应生成不稳定的次氯酸,具有强氧化性,可用于杀菌消毒;
(6)根据n=$\frac{m}{M}$计算2mol氢气完全燃烧放出的热量,结合热化学方程式的书写方法写出热化学方程式.
解答 解:(1)S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,硫离子结构示意图为 ,
,
故答案为: ;
;
(2)铵根离子中4个氢原子与氮原子个共用1对电子,电子式为: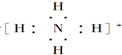 ;
;
故答案为: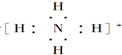 ;
;
(3)非金属性越强,氢化物的稳定性越强,F、Cl、Br、I属于同主族,从上往下,非金属性逐渐减弱,所以其稳定性逐渐减弱,电子层越多,原子半径越大,则原子半径按F、Cl、Br、I的顺序从小到大,H-X键长逐渐增大,键能逐渐减小,不含氢键的氢化物,相对分子质量越大沸点越高,HF分子间含有氢键沸点较高,则卤化氢的沸点由高到低的顺序:HF、HI、HBr、HCl,
故答案为:减弱;增大;减小;HI、HBr、HCl;HF分子间含有氢键;
(4)锌比铜活泼,应为原电池的负极,发生氧化反应,负极的反应式为Zn-2e-═Zn2+,铜为正极,氢离子得电子发生还原反应,2H++2e-=H2↑,电子从负极流向正极,阳离子从负极移向正极,
故答案为:Zn-2e-═Zn2+;还原;负;正极;
(5)漂白粉的主要成分为氯化钙和次氯酸钙,有效成分为次氯酸钙,次氯酸钙和二氧化碳、水反应生成碳酸钙和次氯酸,次氯酸具有漂白性,反应方程式为CO2+H2O+Ca(ClO)2=CaCO3↓+2HClO,反应的离子方程式为:CO2+Ca2++2ClO-+H2O═CaCO3↓+2HClO,
故答案为:CO2+Ca2++2ClO-+H2O═CaCO3↓+2HClO;
(6)4g氢气的物质的量为:n=$\frac{m}{M}$=$\frac{4g}{2g/mol}$=2mol,2molH2在O2中完全燃烧生成2.00mol液态H2O放出571.6kJ的热量,该反应的热化学方程式为:2H2(g)+O2(g)=H2O(l)△H=-571.6KJ/mol;
故答案为:2H2(g)+O2(g)=H2O(l)△H=-571.6KJ/mol.
点评 本题考查较为综合,涉及常见化学用语使用、元素周期律、原电池、热反应方程式的书写等,主要是考查学生对常见化学用语的熟悉掌握程度,题目难度不大.

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案| A. | H2O(g)→H2O(1)+44.0kJ | B. | 2HI(g)→H2(g)+I2(g)-9.4kJ | ||
| C. | 浓硫酸溶于水 | D. |  能量变化如图所示的化学反应 |
| A. | 摩尔质量:mol/g | B. | 物质量:mol | ||
| C. | 溶解度:g/100g | D. | 气体摩尔体积:L/mol |
| A. | 22.4LL任何气体都约含NA个气体分子 | |
| B. | 标准状况下,1mol液溴的体积约为22.4L | |
| C. | 1mol铁与足量盐酸反应,转移电子数为3NA | |
| D. | 18gNH4+中含有的电子数为10NA |
(1)第1步:灼烧,操作是将足量海带灼烧成灰烬,该过程中将用到的实验仪器除铁架台(有铁圈)、酒精灯、坩埚钳、泥三角外,还有B(填代号);
A.试管B.瓷坩埚C.蒸发皿D.烧杯
(2)第2步:含I-溶液的获取,其操作有溶解和过滤;
A.蒸馏B.分液C.过滤
(3)第3步:证明该溶液中含有I-,请你写出第二种不同的方法(试剂自选)
| 方法 | 选用试剂 | 现象 |
| 第一种(萃取) | 氯水、四氯化碳 | 下层溶液显紫色 |
| 第二种 |
| A. | +5、4 | B. | +5、7 | C. | +5、5 | D. | +7、7 |
 糠醛(
糠醛( )可与新制含有NaOH的Cu(OH)2悬浊液在加热条件下反应得到砖红色沉淀Cu2O.
)可与新制含有NaOH的Cu(OH)2悬浊液在加热条件下反应得到砖红色沉淀Cu2O. +Cu2O↓+3H2O.
+Cu2O↓+3H2O.