��Ŀ����
14��������Ϊһ���ִ���ͨ�������ڽ���ǧ��������β���к���CO��NO2���ж����壬����Ⱦ����Ҳ��Ϊ������ἱ���������⣮I����������װβ������װ�ã���ʹCO��NOx�ж��������Ӧת��Ϊ�����壮2xCO+2NOx�T2xCO2+N2����ת�Ƶ������ʵ���Ϊ0.8x molʱ���÷�Ӧ����N2����״���£�4.48L��
II��һ����̼��һ����;�൱�㷺�Ļ�������ԭ�ϣ����Ի�ԭ������������������ϳɺܶ��л�����״���CH3OH���������ѣ�CH3OCH3���ȣ���������ȼ�ϣ�
��1����ѹǿΪ0.1MPa�����£���a mol CO��3a mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״���CO��g��+2H2��g��?CH3OH��g����H��0
�������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���BD��
A�������¶� B����CH3OH��g������ϵ�з���
C������He��ʹ��ϵ��ѹǿ���� D���ٳ���2mol CO��6mol H2
��2����ˮ����ͨ�����ȵ�̿���ɲ���ˮú������ӦΪC��s��+H2O��g��?CO��g��+H2��g����H=+131.3kJ•mol-1��һ���¶��£���һ���ݻ��ɱ���ܱ������У�����������Ӧ���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����bd������ĸ����ͬ����
a�������е�ѹǿ����
b��1mol H-H�����ѵ�ͬʱ������2mol H-O��
c��c��CO��=c��H2��
d���ܱ��������ݻ����ٸı�
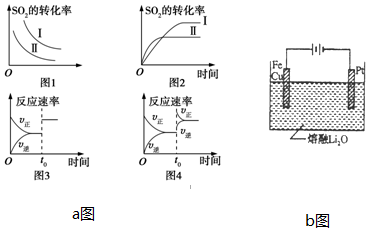
��3��ij�о�С���о���������������ʱ���ı������Կ��淴Ӧ��2SO2��g��+O2��g��?2SO3��g����H��0��Ӱ�죮����˵����ȷ����D
A��aͼ��ͼ1�о������¶ȡ�ѹǿ��ƽ���Ӱ�죬�����ʾѹǿ
B��aͼ��ͼ2�о������¶ȶ�ƽ���Ӱ�죬����õ��¶ȸ���
C��aͼ��ͼ3��t0ʱʹ���˴�����ʹƽ��������Ӧ�����ƶ�
D��aͼ��ͼ4��t0ʱ����ѹǿ��ʹƽ��������Ӧ�����ƶ�
��4��һ�������£�CO��H2�ɺϳɼ��飬��Ӧ����ʽΪCO��g��+3H2��g��?CH4 ��g��+H2O��g��
��һ�������£��÷�Ӧ�ܹ��Է����е�ԭ����2CO��g��+2H2��g��?CO2��g��+CH4��g����H=��2a+2b-c��KJ/mol��
����֪H2��g����CO��g������CH4 ��g����ȼ�ա�H�ֱ����aKJ/mol��bkJ/mol��cKJ/mol��д��CO��H2��Ӧ����CH4��CO2���Ȼ�ѧ����ʽAgCl+2NH3•H2O=Ag��NH3��2++Cl-+2H2O��
��5���״���ȡ��ȩ����Ag������������AgCl��Ӱ��Ag�����Ļ��ԣ��ð�ˮ�����ܽ��ȥ���е�AgCl��д���÷�Ӧ�����ӷ���ʽ��AgCl+2NH3•H2O=Ag��NH3��2++Cl-+2H2O��
��6��CuFe2O4���õ绯ѧ�����õ�����ԭ����bͼ��ʾ���������ĵ缫��ӦʽΪCu+2Fe+4O2--8e-=CuFe2O4��
��7����H2Ϊȼ�Ͽ���������ȼ�ϵ�أ���֪2H2��g��+O2��g���T2H2O��l����H=-572kJ•mol-1ij����ȼ�ϵ���ͷ�228.8kJ����ʱ������1molҺ̬ˮ���õ�ص�����ת����Ϊ80%��
���� �����ݻ�ѧ����ʽ��Ԫ�ػ��ϼ۱仯�������ת��������ÿ����1molN2����ת��0.4xmol���Ӽ��㣻
��1�����Ӽ״�������Ҫƽ��������У�����ƽ���ƶ�ԭ����Ϸ�Ӧ���������������С�ķ��ȷ�Ӧ����ѡ���жϣ�
��2����Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ�ƽ��ʱ�������ʵ����ʵ�����Ũ�ȡ������Ȳ��ٷ����仯���Լ��ɴ����������������䣬���ɴ˽����жϣ�
��3�������¶ȣ���ѧ��Ӧ���ʼӿ죬ƽ���������ȵķ����ƶ�������ѹǿ����ѧ��Ӧ���ʼӿ죬ƽ���������������С�ķ����ƶ���ʹ�ô������ӿ컯ѧ��Ӧ���ʣ���ƽ�ⲻ����Ӱ�죻
��4���������Է����е��ж����ݡ�H-T��S��0������
������ȼ����д����Ӧ���Ȼ�ѧ����ʽ����ϸ�˹���ɼ���õ���
��5���Ȼ����м��백ˮ��������Ϸ�Ӧ����������������ӣ�
��6��������Fe��Cuʧ���Ӻ������ӷ�Ӧ����CuFe2O4��
��7�������Ȼ�ѧ��Ӧ����ʽ��������1molˮ�ų���������������ȼ�ϵ���ͷ�228.8KJ�����������ص�����ת���ʣ�
��� �⣺I.2xCO+2NOx�T2xCO2+N2����Ӧ������1molN2����ת��2xmol���ӣ���ת�Ƶ������ʵ���Ϊ0.8x molʱ����Ӧ���ɵ���0.2mol��
��״�����������Ϊ0.2mol��22.4L/mol=4.48L��
�ʴ�Ϊ��4.48L��
II����1����Ӧ�����������С�ķ��ȷ�Ӧ���������ݻ����䣬���д�ʩ�����Ӽ״����ʣ�
A�������¶ȣ�ƽ��������У��״����ʼ�С����A����
B����CH3OH��g������ϵ�з��룬ƽ��������У��״���������B��ȷ��
C������He��ʹ��ϵ��ѹǿ����ѹ���䣬ƽ�ⲻ������C����
D���ٳ���2mol CO��6mol H2 ����Ӧ��Ũ������ƽ��������У��״���������D��ȷ��
�ʴ�Ϊ��BD��
��2��a����Ӧǰ����������ʵ����������仯��������ʼ��ѹǿ���䣬����˵����Ӧ����ƽ�⣬��a����
b��l molH-H�����ѵ�ͬʱ����2mol H-O��������2mol H-O��ͬʱ����l molH-H����˵����Ӧ����ƽ�⣬��b��ȷ��
c��c��CO��=c��H2��������뷴Ӧ������йأ����ݷ�Ӧ��֪����ʼ����c��CO��=c��H2��������˵����Ӧ����ƽ�⣬��c����
d����Ӧǰ��ǰ��������ͬ���������˵�����淴Ӧ������ȣ������Ũ�Ȳ��䣬��Ӧ�ﵽƽ��״̬����d��ȷ��
��ѡ��bd��
��3��A������ѹǿ��ƽ�������ƶ������������ת��������A����
B�������¶ȣ���Ӧ��������ƽ�������ƶ���ת���ʼ�С������õ��¶ȸ��ߣ���B����
C�����������ƽ�ⲻ�ƶ�����C����
D����Ӧ�����������֮�ʹ������������ѹǿ��ƽ��������Ӧ�����ƶ�����D��ȷ��
�ʴ�Ϊ��D��
��4����CO��g��+3H2��g��?CH4��g��+H2O��g������Ӧ��S��0�������Է����е��ж����ݡ�H-T��S��0�����ԡ�H��0���ʴ�Ϊ���÷�Ӧ��H��0��
��H2��g����CO��g���� CH4��g����ȼ���ȷֱ�Ϊ285.8kJ•mol-1��283.0kJ•mol-1��890��0kJ•mol-1��
a��H2��g��+$\frac{1}{2}$O2��g��=H2O��l����H=akJ•mol-1
b��CO��g��+$\frac{1}{2}$O2��g��=CO2 ��g����H=bkJ•mol-1
c��CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=ckJ•mol-1
���ݸ�˹���ɣ�b+a����2-c�õ�2CO��g��+2H2��g��?CH4��g��+C02��g����H=��2a+2b-c��KJ/mol��
�ʴ�Ϊ��2CO��g��+2H2��g��?CO2��g��+CH4��g����H=��2a+2b-c��KJ/mol��
��5���Ȼ����백ˮ������Ϸ�Ӧ�����ӷ���ʽ��AgCl+2NH3•H2O=Ag��NH3��2++Cl-+2H2O��
�ʴ�Ϊ��AgCl+2NH3•H2O=Ag��NH3��2++Cl-+2H2O��
��6��������Fe��Cuʧ���Ӻ������ӷ�Ӧ����CuFe2O4��������ӦʽΪCu+2Fe+4O2--8e-�TCuFe2O4��
�ʴ�Ϊ��Cu+2Fe+4O2--8e-=CuFe2O4��
��7����2H2��g��+O2��g���T2H2O��I����H=-572KJ��mol-1��֪������1molˮʱ�ų�������Ϊ572KJ��$\frac{1}{2}$=286KJ��
���ص�����ת����ΪΪ$\frac{228.8kJ}{286kJ}$��100%=80%���ʴ�Ϊ��80%��
���� ����ϸ��ӣ������֪ʶ��࣬ע���˻���֪ʶ�ͻ������ܵ�ѵ����ͬʱ�����¿γ̸ĸ��ָ��˼�룬��ȷ������ԭ��Ӧ��ƽ���ƶ����绯ѧ��֪ʶ���ǽ����Ĺؼ���

| A�� | ������ϩ | B�� | ��ľ���� | C�� | �л����� | D�� | �ֻ����� |
| A�� | ���Ӳ��� | B�� | ԭ�Ӻ��������� | C�� | ԭ�Ӱ뾶 | D�� | ���������� |
| A�� | g/L | B�� | mol/L | C�� | g/mol | D�� | mol |
 ��ͼ��ʾ���Թ���ʢװ���Ǻ���ɫ���壨�����ǻ�������������ʢ��ˮ��ˮ����ʱ���Թ���ˮ�������������ܳ����Թܣ������Թ��ڹ����������Թ۲쵽�Թ���ˮ��������������������ظ����Թ�����ȫ��ˮ������ԭ���Թ���ʢװ�Ŀ�����ʲô���壨������
��ͼ��ʾ���Թ���ʢװ���Ǻ���ɫ���壨�����ǻ�������������ʢ��ˮ��ˮ����ʱ���Թ���ˮ�������������ܳ����Թܣ������Թ��ڹ����������Թ۲쵽�Թ���ˮ��������������������ظ����Թ�����ȫ��ˮ������ԭ���Թ���ʢװ�Ŀ�����ʲô���壨������| A�� | ������N2��NO2�Ļ������ | B�� | ������O2��NO2�Ļ������ | ||
| C�� | һ����NO��NO2�Ļ������ | D�� | ֻ������NO2һ������ |
| A�� | ��������ľ̿���� | B�� | �ռ��ۻ� | ||
| C�� | ̼��Ƹ��·ֽ� | D�� | HCl����ˮ |
 ��
�� ��
��