题目内容
3.下列反应的离子方程式书写正确的是( )| A. | 4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ | |
| B. | 硫酸氢钠溶液与氢氧化钡溶液混合显中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| C. | 稀硝酸中加入过量的铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 向AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
分析 A.设溶液体积为1L,偏铝酸钠和HCl的物质的量分别为4mol、7mol,4mol偏铝酸钠消耗4molHCl生成4mol氢氧化铝沉淀,剩余的3molHCl能够溶解1mol氢氧化铝,据此判断反应错误;
B.反应后溶液呈中性,则硫酸氢钠与氢氧化钡按照物质的量2:1反应;
C.铁粉过量,反应生成的是亚铁离子;
D.一水合氨为弱碱,二者反应生成氢氧化铝沉淀.
解答 解:A.设溶液体积为1L,1L 4mol/L的NaAlO2溶液中含有4mol偏铝酸钠,1L 7mol/L的HCl中含有7molHCl,4molNaAlO2消耗4molHCl生成4molAl(OH)3,剩余的3molHCl能够溶解1molAl(OH)3,反应后氢氧化铝与铝离子的物质的量之比为3:1,反应的离子方程式为:等体积互相均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+,故A正确;
B.硫酸氢钠溶液与氢氧化钡溶液混合显中性,氢离子与氢氧根离子的物质的量相等,正确的离子方程式为:2H++SO42-+Ba2++2OH-═2H2O+BaSO4↓,故B错误;
C.稀硝酸中加入过量的铁粉,反应生成硝酸亚铁、NO气体和水,正确的离子方程式为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故C错误;
D.氯化铝与氨水反应生成氢氧化铝沉淀和氯化铵,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等;A为易错点,正确判断反应物过量情况为解答关键.

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案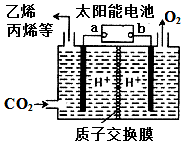
| A. | a电极为太阳能电池的正极 | |
| B. | 产生丙烯的电极反应式为:3CO2+18H++18e-═CH3CH=CH2+6H2O | |
| C. | 装置中每转移2e-,理论上有2molH+通过质子交换膜从左向右扩散 | |
| D. | 太阳能电池的原理与原电池的原理相同 |
| A. | 观察气体的颜色 | B. | 用干燥的蓝色石蕊试纸 | ||
| C. | 用硝酸银溶液 | D. | 用湿润的淀粉碘化钾试纸 |
| A. | 醋酸与氢氧化钠溶液反应:OH-+H+═H2O | |
| B. | 氯气与水反应:Cl2+H2O?Cl-+HClO+H+ | |
| C. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| D. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ |
①增加反应物的物质的量
②升高温度
③缩小反应容器的体积
④不断分离出生成物.
| A. | 4项 | B. | 3项 | C. | 2项 | D. | 1项 |
| A. | X=Y=Z | B. | X=Y<Z | C. | X>Y=Z | D. | X<Y=Z |
| A. | 10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% | |
| B. | 在H2O2+Cl2═2HCl+O2反应中,每生成32 g氧气,则消耗NA个Cl2分子 | |
| C. | 标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g | |
| D. | 一定温度下,1 L 0.50 mol•L-1 NaCl溶液与2 L 0.25 mol•L-1 Na2CO3溶液含Na+的物质的量不同 |
C(s)+$\frac{1}{2}$O2 (g)═CO(g)△H1=-110.5KJ/mol
C(s)+O2(g)═CO2(g)△H2=-393.5KJ/mol
则C(s)+CO2(g)═2CO (g)的△H为( )
| A. | +172.5KJ/mol | B. | -172.5KJ/mol | C. | -110.5KJ/mol | D. | -504 KJ/mol |
| A. | NaHCO3溶液与盐酸:CO32-+2H+═H2O+CO2↑ | |
| B. | 硝酸银溶液与铜:Cu+Ag+═Cu2++Ag | |
| C. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++CO32- | |
| D. | 用醋酸除水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+H2O+CO2↑ |