题目内容
8.pH相同的CH3COOH、HCl和H2SO4溶液,分别用蒸馏水稀释到原来的X、Y、Z倍,稀释后三种溶液的pH仍然相同,则X、Y、Z的关系是( )| A. | X=Y=Z | B. | X=Y<Z | C. | X>Y=Z | D. | X<Y=Z |
分析 CH3COOH是弱电解质而在水溶液中部分电离,HCl、H2SO4是强电解质而在水溶液中完全电离,而c(H+)相同时c(CH3COOH)最大,加水稀释过程中促进CH3COOH电离,如果稀释相同的倍数,醋酸中c(H+)大,为保证稀释后pH相同,则弱酸加水较多,以此来解答.
解答 解:因pH相同的CH3COOH、HCl和H2SO4溶液,稀释相同倍数时,强酸的pH变化大,
分别用蒸馏水稀释到原来的X、Y、Z倍,稀释后三种溶液的pH仍然相同,可知盐酸、硫酸加水相同,醋酸加水最多,
则X、Y、Z的关系是X>Y=Z,
故选C.
点评 本题考查溶液稀释的pH计算,为高频考点,把握弱酸存在电离平衡及稀释时pH的变化为解答的关键,侧重分析与应用能力的考查,注意等pH时稀释相同倍数强酸的pH变化大,题目难度不大.

练习册系列答案
相关题目
7.用如图所示装置和相应试剂能达到实验目的是( )
| 选项 | 实验目的 | 试剂a | 试剂b | 试剂c | 装置 |
| A | 验证非金属性:S>C>Si | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 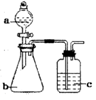 |
| B | 制备纯净的氯气 | 浓盐酸 | MnO2 | 饱和食盐水 | |
| C | 检验溶液X 中含有CO32- | 盐酸 | 溶液X | 澄清石灰水 | |
| D | 除去Na2SO3 中的Na2SO4 | 氯水 | 混合物 | NaOH 溶液 |
| A. | A | B. | B | C. | C | D. | D |
19.下列说法正确的是( )
| A. | SO2通入BaCl2溶液中无现象,加入氨水后得到BaSO4沉淀 | |
| B. | SO2通入酸性KMnO4溶液中,溶液褪色,体现SO2的漂白性 | |
| C. | SO2通入紫色石蕊试液中,溶液变红色 | |
| D. | 等物质的量的SO2和Cl2通入水中,溶液的漂白性增强 |
16.分类是学习和研究化学的一种重要方法,下列分类合理的是( )
| A. | K2CO3和K2O都属于钾盐 | B. | H2SO4和HNO3都属于酸 | ||
| C. | KOH和Na2CO3都属于碱 | D. | Na2O和Na2CO3都属于氧化物 |
3.下列反应的离子方程式书写正确的是( )
| A. | 4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ | |
| B. | 硫酸氢钠溶液与氢氧化钡溶液混合显中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| C. | 稀硝酸中加入过量的铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 向AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
13.下列过程与加成反应有关的是( )
| A. | 苯与溴水混合振荡,水层颜色变浅 | |
| B. | 乙烯与溴水混合振荡,水层颜色变浅 | |
| C. | 乙烯与高锰酸钾溶液混合振荡,溶液颜色变浅 | |
| D. | 甲烷与氯气混合光照,气体颜色变浅 |
20.下列叙述正确的是( )
| A. | 原电池将电能转化为化学能 | B. | 电解池将化学能转化为电能 | ||
| C. | 原电池的负极失电子 | D. | 电解池的阳极发生还原反应 |
17.已知:将Cl2通入适量浓NaOH溶液恰好完全反应,产物中可能有NaCl、NaClO、NaClO3、且$\frac{{c(C{l^-})}}{{c(Cl{O^-})}}$的值仅与温度高低有关,当n(NaOH)=6a mol时,下列有关说法正确的是( )
| A. | 参加反应的氯气的物质的量为6a mol | |
| B. | 改变温度,产物中NaCl的最小理论产量为4a mol | |
| C. | 改变温度,反应中转移电子的物质的量n的范围:3a mol≤n≤5a mol | |
| D. | 某温度下,若反应后$\frac{{c(C{l^-})}}{{c(Cl{O^-})}}$=6,则溶液中$\frac{{c(C{l^-})}}{c(ClO_3^-)}=\frac{1}{2}$ |
13.下列有关FeBr2溶液的叙述错误的是(NA代表阿伏加德罗常数的数值)( )
| A. | 该溶液中Cu2+、NH4+、SO42-、Cl-可以大量共存 | |
| B. | 与硝酸酸化的AgNO3溶液反应有淡黄色沉淀生成并放出气体 | |
| C. | 向含有1 mol FeBr2的溶液中通入33.6 L Cl2,反应转移电子数目为3NA | |
| D. | 向该溶液中通入过量Cl2,反应的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |