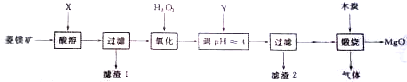
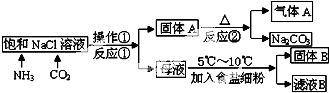
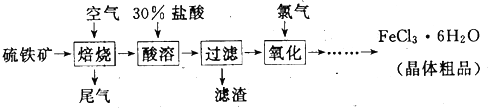
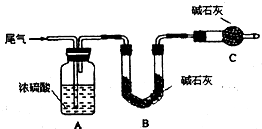
题目内容
(1)等物质的量的CO与CO2之间:二者的质量之比为 ,所含氧原子数之比为 .
(2)在标准状况下,CO和CO2混合气体的质量为32g,体积为22.4L,则其中CO所占的体积为 ,CO2所占的质量为 .
(3)根据下列微粒的结构示意图,写出相应的原子或离子符号:
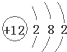 ,
, .
.
(2)在标准状况下,CO和CO2混合气体的质量为32g,体积为22.4L,则其中CO所占的体积为
(3)根据下列微粒的结构示意图,写出相应的原子或离子符号:
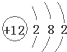

考点:物质的量的相关计算,分子、原子、离子
专题:
分析:(1)根据m=nM计算二者质量之比,二者物质的量相等,分子数目相等,CO含有氧原子数目大于CO分子数目,二氧化碳含有O原子数目等于二氧化碳分子的2倍;
(2)根据n=
计算混合气体物质的量,再根据二者质量、物质的量列方程计算各自物质的量,根据V=nVm计算CO的体积,根据m=nM计算CO2的质量;
(3)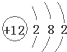 质子数为12,核外电子数为12,表示Mg原子;
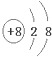
质子数为12,核外电子数为12,表示Mg原子; 质子数为8,核外电子数为10,表示氧离子.
质子数为8,核外电子数为10,表示氧离子.
(2)根据n=
| V |
| Vm |
(3)
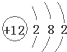 质子数为12,核外电子数为12,表示Mg原子;
质子数为12,核外电子数为12,表示Mg原子; 质子数为8,核外电子数为10,表示氧离子.
质子数为8,核外电子数为10,表示氧离子.解答:
解:(1)根据m=nM可知,等物质的量的CO与CO2者的质量之比为28g/mol:44g/mol=7:11,二者物质的量相等,分子数目相等,CO含有氧原子数目大于CO分子数目,二氧化碳含有O原子数目等于二氧化碳分子的2倍,故二者含有氧原子数目之比为1:2,故答案为:7:11;1:2;
(2)混合气体物质的量为
=1mol,设CO和CO2的物质的量分别为xmol、ymol,根据二者质量、总物质的量,则:
,解得x=0.75,y=0.25,故V(CO)=0.75mol×22.4L/mol=16.8L,m(CO2)=0.25mol×44g/mol=11g,故答案为:16.8L;11g;
(3)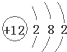 质子数为12,核外电子数为12,表示Mg原子;
质子数为12,核外电子数为12,表示Mg原子; 质子数为8,核外电子数为10,表示O2-,故答案为:Mg;O2-.
质子数为8,核外电子数为10,表示O2-,故答案为:Mg;O2-.
(2)混合气体物质的量为
| 22.4L |
| 22.4L/mol |
|
(3)
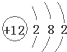 质子数为12,核外电子数为12,表示Mg原子;
质子数为12,核外电子数为12,表示Mg原子; 质子数为8,核外电子数为10,表示O2-,故答案为:Mg;O2-.
质子数为8,核外电子数为10,表示O2-,故答案为:Mg;O2-.
点评:本题考查物质的量有关计算、原子结构示意图,难度不大,有利于基础知识的巩固.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
欲使CH3COONa稀溶液中的
值增大,可采取的措施是( )
| c(CH3COO-) |
| c(Na+) |
| A、升温 |
| B、加水稀释 |
| C、加少量的KOH固体 |
| D、加少量固体Na2CO3 |
工业上生产下列物质,不涉及氧化还原反应的是( )
| A、用铝矾土(主要成分Al2O3)生产金属铝 |
| B、用硫铁矿(主要成分FeS2)生产硫酸 |
| C、用海水、贝壳生产氯化镁晶体 |
| D、用氯化钠生产烧碱 |
下列各组物质中,正确的是( )
| A、标况下11.2 L CCl4和0.5NA个NO2 分子个数相同 |
| B、1 mol NH3和22.4 L Ne的电子数相等 |
| C、4℃时,36 mL 水和2×105Pa,27℃时32 g O2氧原子数相同 |
| D、1×105Pa,0℃时22.4 L SO3和含4mol氧原子的H2SO4分子数 |
下列叙述中正确的是( )
| A、纯碱从物质的分类看不属于碱 |
| B、由一种元素组成的物质一定是单质 |
| C、单质只能用置换反应制取 |
| D、含氧元素的化合物称为氧化物 |
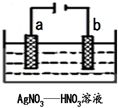 金属冶炼和处理常涉及许多反应.
金属冶炼和处理常涉及许多反应.