题目内容
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3?6H2O)的工艺流程如下:
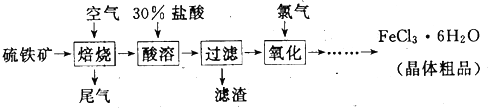
(1)氧化过程中发生反应的离子方程式是 ,检验氧化生成的阳离子的试剂是 .
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
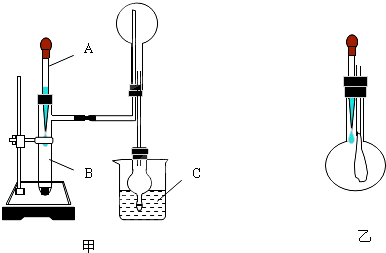
方案一:让尾气缓慢通过以下装置.
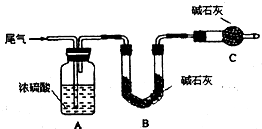
①C仪器的名称是 ,该装置的作用是 .
②实验时先通入尾气,再通入一定量氮气.若通过B装置的增重来测量SO2的体积分数.你认为该方案是否合理 ,请说明理由 (若方案合理该空不必填写).
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g.
①加入过量氯化钡溶液的目的是 .
②进行沉淀洗涤的方法是 .
③SO2含量的表达式是 (用含m、V的代数式表示).
(3)从FeCl3溶液中得到FeCl3?6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .

(1)氧化过程中发生反应的离子方程式是
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置.

①C仪器的名称是
②实验时先通入尾气,再通入一定量氮气.若通过B装置的增重来测量SO2的体积分数.你认为该方案是否合理
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g.
①加入过量氯化钡溶液的目的是
②进行沉淀洗涤的方法是
③SO2含量的表达式是
(3)从FeCl3溶液中得到FeCl3?6H2O晶体的操作包括
考点:制备实验方案的设计
专题:实验设计题
分析:根据流程,黄铁矿在高温下煅烧可以得到铁的氧化物,将其溶于盐酸中,可以得到含有亚铁离子、铁离子的盐溶液,向其中通入氯气,能将亚铁离子氧化为铁离子,氯化铁溶液蒸发浓缩、冷却结晶就可以得到氯化铁的晶体.
(1)氯气能将亚铁离子氧化为铁离子,检验铁离子可以使用硫氰化钾溶液;
(2)方案一:①盛放碱石灰的仪器是干燥管,碱石灰还能吸收空气中的二氧化碳和水,注意防止空气中水以及二氧化碳的干扰;
②碱石灰可以吸收二氧化碳和二氧化硫;
方案二:①二氧化硫可以和溴水之间反应得到硫酸,硫酸和氯化钡之间反应生成硫酸钡沉淀,为保证硫酸根转化为沉淀需要氯化钡过量;
②根据沉淀的洗涤方法来回答;
③根据沉淀的质量结合硫元素守恒得到二氧化硫的体积含量进而计算体积分数;
(3)对溶液蒸发浓缩、冷却结晶就可以得到氯化铁的晶体,但是要注意防止铁离子水解.
(1)氯气能将亚铁离子氧化为铁离子,检验铁离子可以使用硫氰化钾溶液;
(2)方案一:①盛放碱石灰的仪器是干燥管,碱石灰还能吸收空气中的二氧化碳和水,注意防止空气中水以及二氧化碳的干扰;
②碱石灰可以吸收二氧化碳和二氧化硫;
方案二:①二氧化硫可以和溴水之间反应得到硫酸,硫酸和氯化钡之间反应生成硫酸钡沉淀,为保证硫酸根转化为沉淀需要氯化钡过量;
②根据沉淀的洗涤方法来回答;
③根据沉淀的质量结合硫元素守恒得到二氧化硫的体积含量进而计算体积分数;
(3)对溶液蒸发浓缩、冷却结晶就可以得到氯化铁的晶体,但是要注意防止铁离子水解.
解答:
解:黄铁矿在高温下煅烧可以得到铁的氧化物,将其溶于盐酸中,可以得到含有亚铁离子、铁离子的盐溶液,向其中通入氯气,能将亚铁离子氧化为铁离子,氯化铁溶液蒸发浓缩、冷却结晶就可以得到氯化铁的晶体.
(1)黄铁矿在高温下煅烧可以得到铁的氧化物,将其溶于盐酸中,可以得到含有亚铁离子、铁离子的盐溶液,向其中通入氯气,能将亚铁离子氧化为铁离子,氧化过程中发生反应的离子方程式是2Fe2++Cl2=2Cl-+2Fe3+,检验铁离子可以使用硫氰化钾溶液,现象是显示红色,
故答案为:2Fe2++Cl2=2Cl-+2Fe3+;KSCN溶液;
(2)方案一:二氧化硫属于酸性气体,能被碱石灰吸收,B中碱石灰增重的质量即为二氧化硫的质量,
①盛放碱石灰的仪器是干燥管,碱石灰增重的质量即为二氧化硫的质量,但是碱石灰还能吸收空气中的二氧化碳和水,所以C中的碱石灰是吸收空气中的水以及二氧化碳的,防止进入B中干扰试验结果,
故答案为:干燥管;防止空气中的水蒸气、CO2被B装置吸收;
②尾气中主要含N2、O2、SO2和少量的CO2、H2O,其中的水被浓硫酸吸收,但是碱石灰吸收的是二氧化碳和二氧化硫的总质量,测得的体积分数会偏大,所以不能根据碱石灰增重来确定二氧化硫的体积分数,
故答案为:否;尾气中的CO2也能被B装置吸收使所测质量分数偏大;
方案二:二氧化硫可以和溴水之间反应得到硫酸,硫酸和氯化钡之间反应生成硫酸钡沉淀,根据沉淀的质量结合S元素守恒可以得到二氧化硫的量,进而计算体积分数;
①加入过量氯化钡溶液的目的是使生成的SO42-完全转化为沉淀,故答案为:使生成的SO42-完全转化为沉淀;
②沉淀的洗涤方法:在漏斗中加蒸馏水至恰好没过沉淀,待水流下后再重复2~3次此操作,故答案为:在漏斗中加蒸馏水至恰好没过沉淀,待水流下后再重复2~3次此操作;
③硫酸钡沉淀的质量是mg,所以硫元素的物质的量=
mol=二氧化硫的物质的量,所以VL尾气中SO2的体积分数是:
×100%=
%;
故答案为:
%;
(3)氯化铁溶液蒸发浓缩、冷却结晶就可以得到氯化铁的晶体,但是必须在盐酸环境中进行,防止铁离子水解,保证盐酸过量,
故答案为:蒸发浓缩;Fe3++3H2O?Fe(OH)3+3H+,过量盐酸能够抑制Fe3+水解.
(1)黄铁矿在高温下煅烧可以得到铁的氧化物,将其溶于盐酸中,可以得到含有亚铁离子、铁离子的盐溶液,向其中通入氯气,能将亚铁离子氧化为铁离子,氧化过程中发生反应的离子方程式是2Fe2++Cl2=2Cl-+2Fe3+,检验铁离子可以使用硫氰化钾溶液,现象是显示红色,
故答案为:2Fe2++Cl2=2Cl-+2Fe3+;KSCN溶液;
(2)方案一:二氧化硫属于酸性气体,能被碱石灰吸收,B中碱石灰增重的质量即为二氧化硫的质量,
①盛放碱石灰的仪器是干燥管,碱石灰增重的质量即为二氧化硫的质量,但是碱石灰还能吸收空气中的二氧化碳和水,所以C中的碱石灰是吸收空气中的水以及二氧化碳的,防止进入B中干扰试验结果,
故答案为:干燥管;防止空气中的水蒸气、CO2被B装置吸收;
②尾气中主要含N2、O2、SO2和少量的CO2、H2O,其中的水被浓硫酸吸收,但是碱石灰吸收的是二氧化碳和二氧化硫的总质量,测得的体积分数会偏大,所以不能根据碱石灰增重来确定二氧化硫的体积分数,
故答案为:否;尾气中的CO2也能被B装置吸收使所测质量分数偏大;
方案二:二氧化硫可以和溴水之间反应得到硫酸,硫酸和氯化钡之间反应生成硫酸钡沉淀,根据沉淀的质量结合S元素守恒可以得到二氧化硫的量,进而计算体积分数;
①加入过量氯化钡溶液的目的是使生成的SO42-完全转化为沉淀,故答案为:使生成的SO42-完全转化为沉淀;
②沉淀的洗涤方法:在漏斗中加蒸馏水至恰好没过沉淀,待水流下后再重复2~3次此操作,故答案为:在漏斗中加蒸馏水至恰好没过沉淀,待水流下后再重复2~3次此操作;
③硫酸钡沉淀的质量是mg,所以硫元素的物质的量=
| m |
| 233 |
| ||
| V |
| 2240m |
| 233V |
故答案为:
| 2240m |
| 233V |
(3)氯化铁溶液蒸发浓缩、冷却结晶就可以得到氯化铁的晶体,但是必须在盐酸环境中进行,防止铁离子水解,保证盐酸过量,
故答案为:蒸发浓缩;Fe3++3H2O?Fe(OH)3+3H+,过量盐酸能够抑制Fe3+水解.
点评:本题是一道物质的分离制备的实验方案设计题,考查学生分析和解决问题的能力,注意知识的迁移和应用是解题的关键,难度较大.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
下列说法正确的是( )
| A、H2O2分子间存在氢键 |
B、在氨水中,大部分NH3与H2O以氢键结合成NH3?H2O分子,可表示为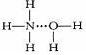 |
| C、石英熔化只与范德华力有关 |
| D、PH3的沸点比NH3高 |
现有含NaCl、Na2SO4和NaNO3的混合溶液,采用下列实验流程加入适当的试剂将其转化为相应的沉淀或固体,实现Cl-、SO42-和NO3-的相互分离其中试剂1、2、4分别为( )
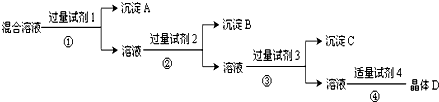

| A、氯化钡溶液 硝酸银溶液 硝酸溶液 |
| B、氯化钡溶液 硝酸溶液 硝酸银溶液 |
| C、NaOH 溶液 硝酸银溶液 硝酸溶液 |
| D、硝酸银溶液 硝酸钡溶液 硝酸溶液 |
 如图为实验室某浓硫酸试剂瓶上的标签,回答有关问题:
如图为实验室某浓硫酸试剂瓶上的标签,回答有关问题: