题目内容
 金属冶炼和处理常涉及许多反应.
金属冶炼和处理常涉及许多反应.(1)由下列物质冶炼相应金属时采用电解法的是
a.Fe2O3b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是
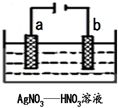
(3)如图为电解精炼银的示意图,
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为
(5)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)
已知:①FeO(s)+CO(g)=Fe(s)+CO2(g)△H1=-11KJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H2=-47KJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H3=+19KJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)的△H=
考点:用盖斯定律进行有关反应热的计算,氧化还原反应的计算,电解原理,金属冶炼的一般原理
专题:
分析:(1)冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的Al2O3)制得;
(2)反应中Cu与S元素的化合价升高,氧气中O元素化合价降低,据此计算转移电子数目;
(3)电解精炼时粗银作阳极;若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮;
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,该装置构成原电池,食盐水作电解质溶液,促进溶液的导电性;
(5)根据已知热化学方程式结合盖斯定律构建目标方程式,再求出反应热.
(2)反应中Cu与S元素的化合价升高,氧气中O元素化合价降低,据此计算转移电子数目;
(3)电解精炼时粗银作阳极;若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮;
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,该装置构成原电池,食盐水作电解质溶液,促进溶液的导电性;
(5)根据已知热化学方程式结合盖斯定律构建目标方程式,再求出反应热.
解答:
解:(1)冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物,由于AlCl3是共价化合物熔融时不导电,所以Al是电解熔融的Al2O3制得;Mg是电解熔融的MgCl2,故答案为:bd;
(2)反应中Cu与S元素的化合价升高,则Cu2S作还原剂,氧气中O元素化合价降低,故1mol氧气反应转移电子为1mol×4=4mol,故答案为:Cu2S;4;
(3)电解精炼时,粗银作阳极,纯银作阴极,所以粗银作阳极,若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮,电极反应式为:2H++NO3-+e-=NO2↑+H2O,
故答案为:2H++NO3-+e-=NO2↑+H2O;
(4)该装置构成原电池,氯化钠溶液作电解质溶液,促进溶液的导电能力,其反应的反应为Al与Ag2S反应生成Al(OH)3、H2S和Ag,则反应的化学方程式为:3Ag2S+2Al+3H2O=2Al(OH)3+3H2S↑+6Ag;
故答案为:作电解质溶液;3Ag2S+2Al+3H2O=2Al(OH)3+3H2S↑+6Ag;
(5)已知:①FeO(s)+CO(g)=Fe(s)+CO2(g)△H1=-11KJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H2=-47KJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H3=+19KJ/mol
由盖斯定律:方程式①×2+②×
+③×
得Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=(-11)×2+(-47)×
+19×
=-25KJ/mol;
故答案为:-25KJ/mol.
(2)反应中Cu与S元素的化合价升高,则Cu2S作还原剂,氧气中O元素化合价降低,故1mol氧气反应转移电子为1mol×4=4mol,故答案为:Cu2S;4;
(3)电解精炼时,粗银作阳极,纯银作阴极,所以粗银作阳极,若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮,电极反应式为:2H++NO3-+e-=NO2↑+H2O,
故答案为:2H++NO3-+e-=NO2↑+H2O;
(4)该装置构成原电池,氯化钠溶液作电解质溶液,促进溶液的导电能力,其反应的反应为Al与Ag2S反应生成Al(OH)3、H2S和Ag,则反应的化学方程式为:3Ag2S+2Al+3H2O=2Al(OH)3+3H2S↑+6Ag;
故答案为:作电解质溶液;3Ag2S+2Al+3H2O=2Al(OH)3+3H2S↑+6Ag;
(5)已知:①FeO(s)+CO(g)=Fe(s)+CO2(g)△H1=-11KJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H2=-47KJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H3=+19KJ/mol
由盖斯定律:方程式①×2+②×
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| 2 |
| 3 |
故答案为:-25KJ/mol.
点评:本题考查了金属的冶炼方法、氧化还原反应、原电池和电解原理、反应热的计算等知识点,根据金属的活泼性确定冶炼方法、离子的放电顺序来分析解答,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某同学设计了以下流程来检验碳酸钾粉末中含有少量氯化钾和氢氧化钾.下列说法不正确的是( )
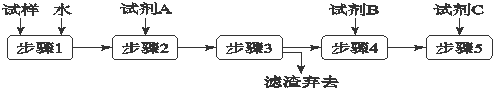

| A、步骤3的操作名称是过滤 |
| B、步骤1所需玻璃仪器是烧杯和玻璃棒 |
| C、试剂A是BaCl2溶液 |
| D、加入试剂A 的目的是除去CO32-并避免对Cl-或OH-的检验的干扰 |
下列关于食物酸碱性的说法错误的是( )
| A、食物的酸碱性是按食物在体内代谢最终产物的性质来分类的 |
| B、酸性食物在体内代谢后可形成阴离子酸根 |
| C、碱性食物在体内代谢后可形成含金属阳离子的碱性物质 |
| D、某些水果酸味很强,它们是酸性食物 |
下列叙述错误的是( )
| A、将CO2通入BaCl2溶液中至饱和,有沉淀产生 |
| B、在NaHCO3溶液中,加入澄清石灰水,有白色沉淀生成 |
| C、向AlCl3溶液中滴加浓氨水,产生白色沉淀;再加入过量浓氨水,沉淀仍不消失 |
| D、向FeCl2溶液中滴入KSCN溶液没有现象,再滴入氯水溶液变红 |
我国城市环境中的大气污染物主要是( )
| A、N2、CO2、Cl2、沙尘 |
| B、SO2、NO2、CO、粉尘 |
| C、SO2、HCl、N2、粉尘 |
| D、NH3、H2S、CO2、雾 |
已知:C(s)+H2O(g)=CO(g)+H2(g)△H=akJ?mol-1 C(s)+
O2(g)=CO(g)△H=-110kJ?mol-1
H-H、O=O和O-H键的键能分别为436、496和462kJ?mol-1,则a为( )
| 1 |
| 2 |
H-H、O=O和O-H键的键能分别为436、496和462kJ?mol-1,则a为( )
| A、-332 | B、-118 |
| C、+350 | D、+130 |