题目内容
我国科学家侯德榜为我国纯碱和氮肥工业技术的发展做出了杰出的贡献.如图是侯氏联合制碱法的工艺流程.
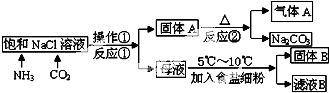
已知 NH4Cl 在常温时的溶解度比 NaCl 大,而在低温下比 NaCl 溶解度小,在 278K~283K时,向NH4Cl溶液中加入食盐细粉,可使 NH4Cl 单独结晶析出.回答下列问题:
(1)操作①用到的玻璃仪器为 ,反应①的离子方程式为: .
(2)分别将NH3和CO2通入饱和食盐水中,正确的通入顺序是 ,理由是 .
(3)流程图中可循环使用的物质有 ,
(4)写出固体B的一种用途 .

已知 NH4Cl 在常温时的溶解度比 NaCl 大,而在低温下比 NaCl 溶解度小,在 278K~283K时,向NH4Cl溶液中加入食盐细粉,可使 NH4Cl 单独结晶析出.回答下列问题:
(1)操作①用到的玻璃仪器为
(2)分别将NH3和CO2通入饱和食盐水中,正确的通入顺序是
(3)流程图中可循环使用的物质有
(4)写出固体B的一种用途
考点:纯碱工业(侯氏制碱法)
专题:实验设计题,元素及其化合物
分析:侯氏联合制碱法:二氧化碳在水中的溶解度较小,氨气极易溶于水,先通入NH3使溶液呈碱性,在氨的饱和NaCl溶液中通入二氧化碳气体,发生NH3+CO2+H2O═NH4HCO3;NH4HCO3+NaCl═NaHCO3↓+NH4Cl,操作①为过滤,得到的A为NaHCO3微小晶体,2NaHCO3
Na2CO3+CO2↑+H2O,气体A为二氧化碳;
母液为NH4Cl溶液,NH4Cl 在低温下比 NaCl 溶解度小,在 278K~283K时,向NH4Cl溶液中加入食盐细粉,可使 NH4Cl 单独结晶析出,固体B为NH4Cl,滤液BNaCl溶液;
(1)依据分离固体与液体采用的实验操作为过滤,根据过滤用到的玻璃仪器分析;碳酸氢钠的溶解度比碳酸钠小,溶液中离子反应的本质为二氧化碳和水结合生成碳酸,氨气和水结合生成一水合氨,碳酸和一水合氨反应,钠离子和碳酸氢根离子结合生成碳酸氢钠沉淀;
(2)氨气极易溶于水,二氧化碳在水中的溶解度较小,先通氨气有利于吸收二氧化碳,确保得到NaHCO3沉淀;
(3)循环利用的物质是既为反应原料,又可为产物为二氧化碳、氯化钠溶液;
(4)副产品氯化铵是一种氮肥,可再利用;
| ||
母液为NH4Cl溶液,NH4Cl 在低温下比 NaCl 溶解度小,在 278K~283K时,向NH4Cl溶液中加入食盐细粉,可使 NH4Cl 单独结晶析出,固体B为NH4Cl,滤液BNaCl溶液;
(1)依据分离固体与液体采用的实验操作为过滤,根据过滤用到的玻璃仪器分析;碳酸氢钠的溶解度比碳酸钠小,溶液中离子反应的本质为二氧化碳和水结合生成碳酸,氨气和水结合生成一水合氨,碳酸和一水合氨反应,钠离子和碳酸氢根离子结合生成碳酸氢钠沉淀;
(2)氨气极易溶于水,二氧化碳在水中的溶解度较小,先通氨气有利于吸收二氧化碳,确保得到NaHCO3沉淀;
(3)循环利用的物质是既为反应原料,又可为产物为二氧化碳、氯化钠溶液;
(4)副产品氯化铵是一种氮肥,可再利用;
解答:
解:侯氏联合制碱法:二氧化碳在水中的溶解度较小,氨气极易溶于水,先通入NH3使溶液呈碱性,在氨的饱和NaCl溶液中通入二氧化碳气体,发生NH3+CO2+H2O═NH4HCO3;NH4HCO3+NaCl═NaHCO3↓+NH4Cl,操作①为过滤,得到的A为NaHCO3微小晶体,2NaHCO3
Na2CO3+CO2↑+H2O,气体A为二氧化碳;
母液为NH4Cl溶液,NH4Cl 在低温下比 NaCl 溶解度小,在 278K~283K时,向NH4Cl溶液中加入食盐细粉,可使 NH4Cl 单独结晶析出,固体B为NH4Cl,滤液BNaCl溶液,
(1)反应①总反应为NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl,操作①为过滤,得到的NaHCO3微小晶体,过滤用到的玻璃仪器有:烧杯、漏斗、玻璃棒,碳酸氢钠的溶解度比碳酸钠小,所以反应①发生NH3+CO2+H2O═NH4HCO3;NH4HCO3+NaCl═NaHCO3↓+NH4Cl,本质为Na++NH3+CO2+H2O═NaHCO3↓+NH4+,
故答案为:烧杯、玻璃棒、漏斗;Na++NH3+CO2+H2O═NaHCO3↓+NH4+;
(2)二氧化碳在水中的溶解度较小,氨气极易溶于水,通入NH3使溶液呈碱性,增大CO2的溶解度,才能产生足够多的HCO3-,以确保得到NaHCO3沉淀,所以应该先通氨气,
故答案为:先通入足量的NH3,再通入足量的CO2;因为通入NH3使溶液呈碱性,增大CO2的溶解度,才能产生足够多的HCO3-,以确保得到NaHCO3沉淀;
(3)①NH3+CO2+H2O═NH4HCO3 ②NH4HCO3+NaCl═NaHCO3+NH4Cl ③2NaHCO3
Na2CO3+CO2↑+H2O,第③步生成的二氧化碳气体A可作为第①步的生产原料,可循环利用;在 278K~283K时,向NH4Cl溶液中加入食盐细粉,可使 NH4Cl 单独结晶析出,可循环利用滤液BNaCl溶液,
故答案为:气体A和滤液B,
(4)含有氮元素的肥料称为氮肥;能为植物提供的营养元素,所以副产品氯化铵是一种氮肥,
故答案为:常用作氮肥;
| ||
母液为NH4Cl溶液,NH4Cl 在低温下比 NaCl 溶解度小,在 278K~283K时,向NH4Cl溶液中加入食盐细粉,可使 NH4Cl 单独结晶析出,固体B为NH4Cl,滤液BNaCl溶液,
(1)反应①总反应为NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl,操作①为过滤,得到的NaHCO3微小晶体,过滤用到的玻璃仪器有:烧杯、漏斗、玻璃棒,碳酸氢钠的溶解度比碳酸钠小,所以反应①发生NH3+CO2+H2O═NH4HCO3;NH4HCO3+NaCl═NaHCO3↓+NH4Cl,本质为Na++NH3+CO2+H2O═NaHCO3↓+NH4+,
故答案为:烧杯、玻璃棒、漏斗;Na++NH3+CO2+H2O═NaHCO3↓+NH4+;
(2)二氧化碳在水中的溶解度较小,氨气极易溶于水,通入NH3使溶液呈碱性,增大CO2的溶解度,才能产生足够多的HCO3-,以确保得到NaHCO3沉淀,所以应该先通氨气,
故答案为:先通入足量的NH3,再通入足量的CO2;因为通入NH3使溶液呈碱性,增大CO2的溶解度,才能产生足够多的HCO3-,以确保得到NaHCO3沉淀;
(3)①NH3+CO2+H2O═NH4HCO3 ②NH4HCO3+NaCl═NaHCO3+NH4Cl ③2NaHCO3
| ||
故答案为:气体A和滤液B,
(4)含有氮元素的肥料称为氮肥;能为植物提供的营养元素,所以副产品氯化铵是一种氮肥,
故答案为:常用作氮肥;
点评:本题考查“侯氏制碱法”,理解其基本原理与流程、反应物、产物的性质等是正确解答本题的关键,题目难度不大.

练习册系列答案
相关题目
对某次酸雨成分的分析数据如下表,此次酸雨的pH约为( )
| 离子 | NH4+ | Na+ | Cl- | NO3- | SO42- |
| 浓度(mol/L) | 2.0×10-5 | 1.9×10-5 | 6.0×10-5 | 2.3×10-5 | 2.8×10-5 |
| A、3 | B、4 | C、5 | D、6 |
下列说法正确的是( )
| A、H2O2分子间存在氢键 |
B、在氨水中,大部分NH3与H2O以氢键结合成NH3?H2O分子,可表示为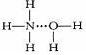 |
| C、石英熔化只与范德华力有关 |
| D、PH3的沸点比NH3高 |