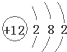题目内容
欲使CH3COONa稀溶液中的
值增大,可采取的措施是( )
| c(CH3COO-) |
| c(Na+) |
| A、升温 |
| B、加水稀释 |
| C、加少量的KOH固体 |
| D、加少量固体Na2CO3 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:醋酸钠溶液中存在醋酸根离子水解平衡:CH3COO-+H2O?CH3COOH+OH-,影响水解平衡移动的因素来回答判断.
解答:
解:A、升温,水解平衡正向移动,所以醋酸根离子浓度减小,但是钠离子浓度不变,即比值会减小,故A错误;
B、加水稀释,促进水解,所以醋酸根离子物质的量减小,而钠离子的物质的量不变,即比值会减小,故B错误;
C、加入KOH固体,钠离子浓度不变,水解平衡向逆向移动,所以醋酸根离子浓度增大,即比值会增大,故C正确;
D、加少量固体Na2CO3,钠离子浓度变大,水解平衡向逆向移动,所以醋酸根离子浓度增大,各度很小,主要以钠离子浓度增大为主,即比值会减小,故D错误;
故选:C.
B、加水稀释,促进水解,所以醋酸根离子物质的量减小,而钠离子的物质的量不变,即比值会减小,故B错误;
C、加入KOH固体,钠离子浓度不变,水解平衡向逆向移动,所以醋酸根离子浓度增大,即比值会增大,故C正确;
D、加少量固体Na2CO3,钠离子浓度变大,水解平衡向逆向移动,所以醋酸根离子浓度增大,各度很小,主要以钠离子浓度增大为主,即比值会减小,故D错误;
故选:C.
点评:本题考查学生盐的水解原理以及影响盐的水解平衡移动等方面的知识,注意知识的归纳整理是解题关键,难度不大.

练习册系列答案
相关题目
下列关于食物酸碱性的说法错误的是( )
| A、食物的酸碱性是按食物在体内代谢最终产物的性质来分类的 |
| B、酸性食物在体内代谢后可形成阴离子酸根 |
| C、碱性食物在体内代谢后可形成含金属阳离子的碱性物质 |
| D、某些水果酸味很强,它们是酸性食物 |
对某次酸雨成分的分析数据如下表,此次酸雨的pH约为( )
| 离子 | NH4+ | Na+ | Cl- | NO3- | SO42- |
| 浓度(mol/L) | 2.0×10-5 | 1.9×10-5 | 6.0×10-5 | 2.3×10-5 | 2.8×10-5 |
| A、3 | B、4 | C、5 | D、6 |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、常温常压下,22.4 L O2含有的分子数目为NA |
| B、1 mol Cl2作为氧化剂得到的电子数为NA |
| C、常温常压下,16 g 氧气含有的氧原子数目为 NA |
| D、0.5 mol/LNa2CO3溶液中,Na+的数目为NA |
NA代表阿伏加德罗常数,下列判断正确的是( )
| A、2.4g金属Mg变为Mg2+时失去的电子数为0.1 NA |
| B、等物质的量的N2和CO所含原子数相同,质量相同 |
| C、在标况下,22.4 L H2O所含氢原子为2NA |
| D、1L 0.1 mol?L-1的乙酸溶液中H+数为0.1 NA |
下列事实中不涉及氧化还原反应的是( )
| A、铜器出现铜绿【Cu2(OH)2CO3】 |
| B、大理石雕像被酸雨损坏 |
| C、燃放烟花爆竹 |
| D、食物腐败变质 |
下列说法正确的是( )
| A、H2O2分子间存在氢键 |
B、在氨水中,大部分NH3与H2O以氢键结合成NH3?H2O分子,可表示为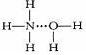 |
| C、石英熔化只与范德华力有关 |
| D、PH3的沸点比NH3高 |