题目内容
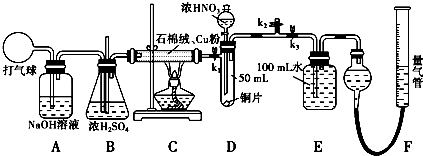
 同学们利用如图装置探究SO2与Na2O2的反应.
同学们利用如图装置探究SO2与Na2O2的反应.(1)同学们认为该反应类似CO2与Na2O2的反应有氧气生成,当通入气体后,如果把带火星的木条伸到导管口,预期现象为带火星的木条复燃.可是,当他们把带火星的木条伸到导管口后,木条并没有复燃,你分析其原因是
(2)反应完毕后,硬质玻璃管中的固体变为白色.大家认为固体成分有多种可能:
假设Ⅰ:全部为Na2SO3;
假设Ⅱ:为Na2SO3和Na2O2的混合物;
假设Ⅲ:
假设Ⅳ:为Na2SO3 和Na2SO4的混合物;
假设Ⅴ:为Na2O2和Na2SO4的混合物.
假设Ⅲ、Ⅳ、Ⅴ的共同理由是
(3)现有下列实验用品:几支试管、带胶塞的导管(单孔)、滴管、药匙、品红溶液、蒸馏水、Ba(NO3)2溶液、BaCl2溶液、稀硫酸、稀盐酸、稀硝酸、浓硫酸、浓盐酸、浓硝酸,请你从中选出合适的用品对“假设Ⅳ”进行验证,完成下表(可以不填满):
| 实验步骤编号 | 实验操作 | 预期现象和结论 |
| ① | / | |
| ② | 向①的试管中加入 | |
| ③ | ||
| ④ |
考点:性质实验方案的设计,二氧化硫的化学性质,钠的重要化合物
专题:
分析:(1)根据把带火星的木条伸到导管口后,木条并没有复燃说明试管口的气体氧气的浓度不够来分析和改进;
(2)类比二氧化碳与过氧化钠的反应推测,过氧化钠与二氧化硫反应可能生成亚硫酸钠,过氧化钠和氧气具有氧化性,反应产物可能为硫酸钠,据此完成假设;
(3)假设Ⅳ反应后的固体为Na2SO3 和Na2SO4的混合物,分别根据具有亚硫酸钠、硫酸钠的方法设计方案,然后选取合适的试剂进行解答.
(2)类比二氧化碳与过氧化钠的反应推测,过氧化钠与二氧化硫反应可能生成亚硫酸钠,过氧化钠和氧气具有氧化性,反应产物可能为硫酸钠,据此完成假设;
(3)假设Ⅳ反应后的固体为Na2SO3 和Na2SO4的混合物,分别根据具有亚硫酸钠、硫酸钠的方法设计方案,然后选取合适的试剂进行解答.
解答:
解:(1)木条并没有复燃说明试管口的气体氧气的浓度不够,结合反应说明到达试管口时还含有大量的二氧化硫气体,所以木条没有复燃;改进的方法就是在检验氧气之前将右边导出气体的导管通入装有烧碱(或强碱)溶液的试管中除去二氧化硫再进行氧气的检验,
故答案为:通入的SO2量太大,产生的氧气太少; 将右边导出气体的导管通入装有烧碱(或强碱)溶液的试管中,再用带火星的木条伸入试管口;
(2)根据CO2与Na2O2的反应可知,SO2与Na2O2反应可能生成Na2SO3,则提出的假设有:假设Ⅰ:全部为Na2SO3,假设Ⅱ:为Na2SO3和Na2O2的混合物;由于Na2O2和反应产物的O2都具有氧化性,则反应后的固体可能为Na2SO,则可能的假设为:假设Ⅲ:全部为Na2SO4 ,假设Ⅳ:为Na2SO3 和Na2SO4的混合物,假设Ⅴ:为Na2O2和Na2SO4的混合物,
故答案为:全部为Na2SO4 ; Na2O2和新产生的O2有强氧化性,能将Na2SO3氧化为Na2SO4 ;
(3)假设Ⅳ:反应后的固体为Na2SO3 和Na2SO4的混合物,需要分别检验亚硫酸钠和硫酸钠,检验亚硫酸钠时,可以通过混合物与稀盐酸反应是否生成使品红溶液褪色的二氧化硫气体完成;检验硫酸钠,可以通过检验是否有不溶于盐酸的硫酸钡白色沉淀生成,检验步骤与现象为:
①待硬质玻管冷却到室温后,用药匙取少量白色固体于试管中,
②向①的试管中加入过量的稀盐酸,塞紧带导管的胶塞,并将导管通入装少量品红溶液的试管,若品红褪色说明生成的二氧化硫,则固体中含有Na2SO3,若品红不褪色则没有生成二氧化硫,固体中不含有Na2SO3;
③取②充分反应后的溶液于试管中,滴入适量BaCl2溶液,若有白色沉淀生成则固体中含有Na2SO4 ,若没有白色沉淀生成则固体中不含有Na2SO4,
故答案为:
故答案为:通入的SO2量太大,产生的氧气太少; 将右边导出气体的导管通入装有烧碱(或强碱)溶液的试管中,再用带火星的木条伸入试管口;
(2)根据CO2与Na2O2的反应可知,SO2与Na2O2反应可能生成Na2SO3,则提出的假设有:假设Ⅰ:全部为Na2SO3,假设Ⅱ:为Na2SO3和Na2O2的混合物;由于Na2O2和反应产物的O2都具有氧化性,则反应后的固体可能为Na2SO,则可能的假设为:假设Ⅲ:全部为Na2SO4 ,假设Ⅳ:为Na2SO3 和Na2SO4的混合物,假设Ⅴ:为Na2O2和Na2SO4的混合物,
故答案为:全部为Na2SO4 ; Na2O2和新产生的O2有强氧化性,能将Na2SO3氧化为Na2SO4 ;
(3)假设Ⅳ:反应后的固体为Na2SO3 和Na2SO4的混合物,需要分别检验亚硫酸钠和硫酸钠,检验亚硫酸钠时,可以通过混合物与稀盐酸反应是否生成使品红溶液褪色的二氧化硫气体完成;检验硫酸钠,可以通过检验是否有不溶于盐酸的硫酸钡白色沉淀生成,检验步骤与现象为:
①待硬质玻管冷却到室温后,用药匙取少量白色固体于试管中,
②向①的试管中加入过量的稀盐酸,塞紧带导管的胶塞,并将导管通入装少量品红溶液的试管,若品红褪色说明生成的二氧化硫,则固体中含有Na2SO3,若品红不褪色则没有生成二氧化硫,固体中不含有Na2SO3;
③取②充分反应后的溶液于试管中,滴入适量BaCl2溶液,若有白色沉淀生成则固体中含有Na2SO4 ,若没有白色沉淀生成则固体中不含有Na2SO4,
故答案为:
| 实验步骤编号 | 实验操作 | 预期现象和结论 |
| ① | 待硬质玻管冷却到室温后 | |
| ② | 过量的稀盐酸 通入装少量品红溶液的试管 | 若品红褪色则固体中含有Na2SO3 |
| ③ | 取②充分反应后的溶液滴入适量BaCl2溶液 | 若有白色沉淀生成则固体中含有Na2SO4 |
点评:本题考查了性质实验方案的设计、常见物质的检验,题目难度中等,注意掌握常见物质的性质及检验方法,明确物质性质实验方案设计与评价的方法,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
若以w1和w2分别表示浓度为xmol?L-1和2xmol?L-1硫酸的质量分数,则下列推断正确的是(硫酸浓度越大密度越大)( )
| A、w2>2w1 |
| B、2w1=w2 |
| C、2w2=w1 |
| D、w1<w2<2w1 |
将甘油溶解于甲苯中得到一混合物,若其中碳元素的质量分数为50%,那么氧元素的质量分数为( )
| A、41.3% | B、8.7% |
| C、1.74% | D、无法计算 |
氧化还原反应的实质是( )
| A、得到氧元素与失去氧元素 |
| B、有无新物质生成 |
| C、化合价的升降 |
| D、电子的得失或共用电子对的偏移 |
 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3?H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3?H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O