题目内容
若以w1和w2分别表示浓度为xmol?L-1和2xmol?L-1硫酸的质量分数,则下列推断正确的是(硫酸浓度越大密度越大)( )
| A、w2>2w1 |
| B、2w1=w2 |
| C、2w2=w1 |
| D、w1<w2<2w1 |
考点:溶液中溶质的质量分数及相关计算
专题:物质的量浓度和溶解度专题
分析:根据c=
表示硫酸的物质的量浓度,结合硫酸的浓度越大密度越大,进行判断.
| 1000ρ×w% |
| M |
解答:
解:设质量分数w1的硫酸密度为ρ1g/mL,质量分数w2的硫酸的为ρ2g/mL,
质量分数w1的硫酸的物质量浓度为x=
mol/L,
质量分数w2的氨水的物质量浓度为2x=
mol/L,
所以2×
mol/L=
mol/L,
故2ρ1w1=ρ2w2,硫酸的浓度越大密度越大,所以ρ1<ρ2,故w1<w2<2w1,
故选:D.
质量分数w1的硫酸的物质量浓度为x=
| 1000ρ1W1 |
| 98 |
质量分数w2的氨水的物质量浓度为2x=
| 1000ρ2w2 |
| 98 |
所以2×
| 1000ρ1W1 |
| 98 |
| 1000ρ2w2 |
| 98 |
故2ρ1w1=ρ2w2,硫酸的浓度越大密度越大,所以ρ1<ρ2,故w1<w2<2w1,
故选:D.
点评:本题考查物质的量浓度的有关计算,难度中等,关键理解物质的量浓度与质量分数之间的关系,注意硫酸的浓度越大、密度越大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法中正确的是(NA表示阿伏加德罗常数的值)( )
| A、常温下,28gFe与足量的浓硝酸反应,转移的电子数为1.5NA |
| B、标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2 |
| C、3.2g铜在硫蒸气中完全燃烧,转移的电子数为0.1NA |
| D、常温常压下,0.1mol氖气含有的电子数为NA |
A、B、C三种短周期元素在元素周期表中的相对位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和为C的质子数,以下说法中不正确的是( )
| A | B |
| C |
| A、B与C均存在同素异形体 |
| B、X的种类比Y的多 |
| C、C的最高价氧化物对应水化物能与A的氢化物形成三种盐 |
| D、沸点:A的氢化物低于C的氢化物 |
下列说法不正确的是( )
| A、分散质粒子直径介于1~100 nm之间的分散系称为胶体 |
| B、江河入海口三角洲的形成通常与胶体的性质有关 |
| C、用激光笔检验淀粉溶液的丁达尔效应 |
| D、向煮沸的1 mol?L-1 NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
NA代表阿伏加德常数,下列说法中,正确的是( )
| A、1mol/LFeCl3溶液中Fe3+数目为NA个 |
| B、2g氢气所含原子数目为NA |
| C、在常温常压下,11.2L氮气所含的原子数目为NA |
| D、17gNH3所含电子数目为10NA |
关于Cl-的说法正确的是( )
| A、Cl-呈黄绿色 |
| B、Cl-有毒 |
| C、Cl-具有氧化性 |
| D、Cl-是稳定结构 |
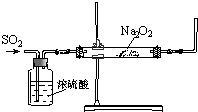 同学们利用如图装置探究SO2与Na2O2的反应.
同学们利用如图装置探究SO2与Na2O2的反应.