题目内容
某研究性学习小组研究HNO3的氧化性,设计了如下实验:在盛有新配制FeS04溶液的试管中滴入2滴KSCN溶液,观察现象,然后再滴人几滴浓HNO3,溶液的颜色变红,但是将红色溶液放置一会儿则发现溶液由红色突然变为蓝色,并产生红棕色气体.这一奇 特现象激起了同学的好奇心与求知欲望,对此现象设计了探究性实验.
(1)实验室粗略配制一定质量分数的硫酸亚铁溶液的方法是:将一定质量的绿矾(FeS04?7H20)置于烧杯中, .
(2)提出假设:
甲同学认为是FeS04与HN03作用; 乙同学认为是KSCN与HNO3作用
(3)根据乙同学的观点,设计了如下实验方案进行验证:向浓HN03中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体.继续滴入KSCN,溶液变为浅蓝色,最后变成无色.将产生的气体通人过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(该气体是空气中的主要成分之一);向反应后的溶液中加入BaC12溶液产生白色沉淀.
写出向浓HNO3中滴入KSCN溶液反应的离子方程式: .
丙同学认为还应设计K2S04溶液与浓硝酸作用的实验,他的理由是 .
(4)延伸探究:丁同学认为SCN-的性质还应进一步探究,查资料发现:(SCN)2是一种“拟卤素”,与C12、Br2有相似的性质.他据此设计了以下方案:向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均变为黄色.请写出Fe(SCN)3与氯气反应的离子方程式: .
(5)通过本次探究,可以得出以下结论:
a、用SCN-间接检验Fe2+时加入氧化剂应注意 (填“少量”、“过量”);
b、与SCN-反应使溶液变红的不一定是Fe3+.
(1)实验室粗略配制一定质量分数的硫酸亚铁溶液的方法是:将一定质量的绿矾(FeS04?7H20)置于烧杯中,
(2)提出假设:
甲同学认为是FeS04与HN03作用; 乙同学认为是KSCN与HNO3作用
(3)根据乙同学的观点,设计了如下实验方案进行验证:向浓HN03中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体.继续滴入KSCN,溶液变为浅蓝色,最后变成无色.将产生的气体通人过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(该气体是空气中的主要成分之一);向反应后的溶液中加入BaC12溶液产生白色沉淀.
写出向浓HNO3中滴入KSCN溶液反应的离子方程式:
丙同学认为还应设计K2S04溶液与浓硝酸作用的实验,他的理由是
(4)延伸探究:丁同学认为SCN-的性质还应进一步探究,查资料发现:(SCN)2是一种“拟卤素”,与C12、Br2有相似的性质.他据此设计了以下方案:向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均变为黄色.请写出Fe(SCN)3与氯气反应的离子方程式:
(5)通过本次探究,可以得出以下结论:
a、用SCN-间接检验Fe2+时加入氧化剂应注意
b、与SCN-反应使溶液变红的不一定是Fe3+.
考点:性质实验方案的设计
专题:实验设计题
分析:(1)配制一定质量分数的硫酸亚铁溶液时根据二价铁易被氧化和水解进行分析;
(3)依据实验反应的现象和生成产物的检验方法和反应现象推断生成物,依据原子守恒和电荷守恒配平书写离子方程式;
(4)加入氯水、溴水溶液的红色均变为黄色,说明硫氰酸根离子还原性强于Cl-、Br-,根据氧化还原反应书写Fe(SCN)3与氯气反应的离子方程式;
(5)分析实验过程可知,氧化剂过量会氧化硫氰酸铁使红色褪去,影响检验离子检验.
(3)依据实验反应的现象和生成产物的检验方法和反应现象推断生成物,依据原子守恒和电荷守恒配平书写离子方程式;
(4)加入氯水、溴水溶液的红色均变为黄色,说明硫氰酸根离子还原性强于Cl-、Br-,根据氧化还原反应书写Fe(SCN)3与氯气反应的离子方程式;
(5)分析实验过程可知,氧化剂过量会氧化硫氰酸铁使红色褪去,影响检验离子检验.
解答:
解:(1)因为硫酸亚铁溶液中二价铁离子易被氧化和水解,所以配置溶液时即要防氧化又要防水解,故答案为:加入适量的稀硫酸,用玻璃棒搅拌,在加水稀释到要求的浓度,最后加入少量铁粉;
(3)往浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体为二氧化氮气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN溶液变为浅蓝色,最后变为无色.将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,依据元素守恒分析判断气体为二氧化碳,并剩余一种非极性气体推断为氮气;向反应后的溶液中加入BaCl2溶液产生白色沉淀证明生成了硫酸根离子,结合分析产物书写离子方程式为:2SCN-+22NO3-+20H+=2SO42-+2CO2↑+22NO2↑+N2↑+10H2O,
故答案为:2SCN-+22NO3-+20H+=2SO42-+2CO2↑+22NO2↑+N2↑+10H2O;对照实验(验证硫酸钾与浓硝酸是否反应);
(4)向Fe(SCN)3中分别滴加过量的氯水.溴水,溶液的红色均消失变为黄色,证明硫氰酸根离子还原性强于Cl-、Br-,则氯气可以将Fe(SCN)3中的(SCN)2置换出来,实验反应的离子方程式为:2Fe(SCN)3+3Cl2═6Cl-+3(SCN)2+2Fe3+,故答案为:2Fe(SCN)3+3Cl2═6Cl-+3(SCN)2+2Fe3+;
(5)亚铁离子加入的氧化剂若过量会氧化硫氰酸根离子,红色褪去,干扰离子的检验,所以加入的氧化剂不能过量,故答案为:少量.
(3)往浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体为二氧化氮气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN溶液变为浅蓝色,最后变为无色.将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,依据元素守恒分析判断气体为二氧化碳,并剩余一种非极性气体推断为氮气;向反应后的溶液中加入BaCl2溶液产生白色沉淀证明生成了硫酸根离子,结合分析产物书写离子方程式为:2SCN-+22NO3-+20H+=2SO42-+2CO2↑+22NO2↑+N2↑+10H2O,
故答案为:2SCN-+22NO3-+20H+=2SO42-+2CO2↑+22NO2↑+N2↑+10H2O;对照实验(验证硫酸钾与浓硝酸是否反应);
(4)向Fe(SCN)3中分别滴加过量的氯水.溴水,溶液的红色均消失变为黄色,证明硫氰酸根离子还原性强于Cl-、Br-,则氯气可以将Fe(SCN)3中的(SCN)2置换出来,实验反应的离子方程式为:2Fe(SCN)3+3Cl2═6Cl-+3(SCN)2+2Fe3+,故答案为:2Fe(SCN)3+3Cl2═6Cl-+3(SCN)2+2Fe3+;
(5)亚铁离子加入的氧化剂若过量会氧化硫氰酸根离子,红色褪去,干扰离子的检验,所以加入的氧化剂不能过量,故答案为:少量.
点评:本题考查了实验探究物质性质的分析判断,实验步骤和实验现象的分析应用是解题关键,题目难度中等.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
下列说法中正确的是(NA表示阿伏加德罗常数的值)( )
| A、常温下,28gFe与足量的浓硝酸反应,转移的电子数为1.5NA |
| B、标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2 |
| C、3.2g铜在硫蒸气中完全燃烧,转移的电子数为0.1NA |
| D、常温常压下,0.1mol氖气含有的电子数为NA |
NA代表阿伏加德常数,下列说法中,正确的是( )
| A、1mol/LFeCl3溶液中Fe3+数目为NA个 |
| B、2g氢气所含原子数目为NA |
| C、在常温常压下,11.2L氮气所含的原子数目为NA |
| D、17gNH3所含电子数目为10NA |
关于Cl-的说法正确的是( )
| A、Cl-呈黄绿色 |
| B、Cl-有毒 |
| C、Cl-具有氧化性 |
| D、Cl-是稳定结构 |
实验室里需用495mL 0.1mol/L的硫酸铜溶液,以下操作正确的是( )
| A、称取7.68 g硫酸铜,加入500 mL水 |
| B、称取12.5 g胆矾配成500 mL溶液 |
| C、称取8.0 g硫酸铜,加入500 mL水 |
| D、称取12.0 g胆矾配成500 mL溶液 |
 a~e是元素周期表中前四周期元素,请根据表中信息回答下列问题:
a~e是元素周期表中前四周期元素,请根据表中信息回答下列问题: 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.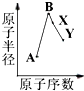 A、B、X、Y是常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;Y的单质是一种常见的半导体材料;X在空气中燃烧可生成两种化合物.
A、B、X、Y是常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;Y的单质是一种常见的半导体材料;X在空气中燃烧可生成两种化合物. 同学们利用如图装置探究SO2与Na2O2的反应.
同学们利用如图装置探究SO2与Na2O2的反应.