题目内容
将甘油溶解于甲苯中得到一混合物,若其中碳元素的质量分数为50%,那么氧元素的质量分数为( )
| A、41.3% | B、8.7% |
| C、1.74% | D、无法计算 |
考点:元素质量分数的计算
专题:
分析:甲苯分子式为C7H8,甘油分子式为C3H8O3,二者相对分子质量都是92,H元素的质量分数相同,混合后H元素的质量分数不变,w(O)=1-w(C)-w(H),据此计算判断.
解答:
解:甲苯分子式为C7H8,甘油分子式为C3H8O3,二者相对分子质量都是92,H元素的质量分数相同为
=8.7%,碳元素的质量分数为50%,故氧元素质量分数=1-50%-8.7%=41.3%,故选A.
| 8 |
| 92 |
点评:本题主要考查质量分数的有关计算,难度不大,关键是根据分子式判断二者氢元素的质量分数相等.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
A、B、C三种短周期元素在元素周期表中的相对位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和为C的质子数,以下说法中不正确的是( )
| A | B |
| C |
| A、B与C均存在同素异形体 |
| B、X的种类比Y的多 |
| C、C的最高价氧化物对应水化物能与A的氢化物形成三种盐 |
| D、沸点:A的氢化物低于C的氢化物 |
关于Cl-的说法正确的是( )
| A、Cl-呈黄绿色 |
| B、Cl-有毒 |
| C、Cl-具有氧化性 |
| D、Cl-是稳定结构 |
已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-12CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ?mol-1H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1下列说法正确的是( )
| A、H2(g)的燃烧热为571.6 kJ?mol-1 | ||||||
| B、同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | ||||||
C、
| ||||||
| D、3H2(g)+CO2(g)=CH3OH(l)+H2O(l)△H=+135.9 kJ?mol-1 |
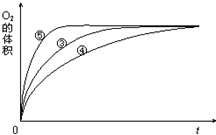 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.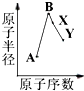 A、B、X、Y是常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;Y的单质是一种常见的半导体材料;X在空气中燃烧可生成两种化合物.
A、B、X、Y是常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;Y的单质是一种常见的半导体材料;X在空气中燃烧可生成两种化合物.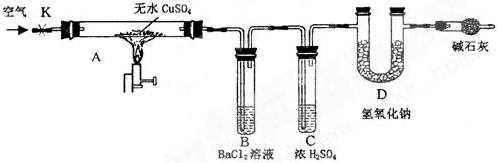
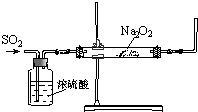 同学们利用如图装置探究SO2与Na2O2的反应.
同学们利用如图装置探究SO2与Na2O2的反应.