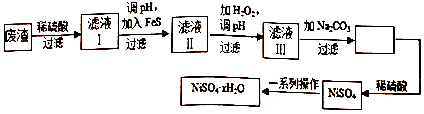
题目内容
1.下列仪器及其名称不正确的是( )| A. |  量筒 | B. |  蒸发皿 | C. |  烧瓶 | D. |  分液漏斗 |
分析 A.图中为量筒,用于量取一定体积的液体;
B.图中为坩埚;
C.图中为圆底烧瓶,用于蒸馏或作反应容器;
D.图中为分液漏斗,可用于分液或萃取.
解答 解:图中量筒、烧瓶、分液漏斗均合理,只有蒸发皿应为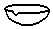 ,
,
故选B.
点评 本题考查常见的化学实验仪器,为高频考点,把握图中仪器及对应的名称为解答的关键,侧重分析与实验能力的考查,注意蒸发皿用于蒸发操作,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.某研究性学习小组设计实验用30mL浓硫酸与10mL无水乙醇共热制备乙烯气体、并测定乙醇转化成乙烯的转化率.已知生成的乙烯气体中含有SO2、CO2、乙醇和乙醚等杂质.有关数据如表:
(1)制备乙烯
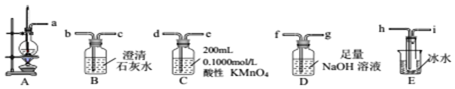
①从A~E中选择必要的装置完成实验,并按气流方向连接的顺序为a→h、i→f、g→d(填仪器接口的字母编号).
②D装置中发生反应的离子方程式SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O实验后,检验D溶液中含有CO32-的实验方案为取少许D溶液于试管中,先滴加足量的双氧水,然后再加入一定量的硫酸,产生能使澄清石灰水浑浊的气体,则证明D溶液中含有CO32-.
③E装置的主要作用是冷凝并收集乙醚.
(2)测定乙烯
反应结束后,用移液管移取C中溶液20mL(不考虑溶液体积变化)于锥形瓶中,先加入约2mL稀硫酸酸化.再用0.1000mol/L的Na2C2O4溶液滴定未反应完的KMnO4.
已知:C2H4$→_{H+}^{KMnO_{4}}$CO2+H2O;C2O42- $→_{H+}^{KMnO_{4}}$CO2+H2O;MnO4-→Mn2+
④以下情况使得测定乙烯的量偏高的是CD
A.在用蒸馏水清洗碱式滴定管后,直接装Na2C2O4标准液
B.锥形瓶清洗干净后残有大量水珠
C.滴定前,滴定管内无气泡,滴定后有气泡
D.读数时,滴定前平视,滴定后俯视
⑤油定终点的现象为溶液由粉红色变成无色,且半分钟内不变色.
⑥已知用去Na2C2O4溶液20.00mL,则乙醇转化成乙烯的转化率为2.94%.
| 熔点/℃ | 沸点/℃ | 溶解性 | 颜色状态 | 密度g/cm3 | |
| 乙醇 | -114.1 | 78.3 | 与水、有机溶剂互溶 | 无色液体 | 0.79 |
| 乙醚 | -116.2 | 34.5 | 不溶于水,易溶于有机溶剂 | 无色液体 | 0.7135 |

①从A~E中选择必要的装置完成实验,并按气流方向连接的顺序为a→h、i→f、g→d(填仪器接口的字母编号).
②D装置中发生反应的离子方程式SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O实验后,检验D溶液中含有CO32-的实验方案为取少许D溶液于试管中,先滴加足量的双氧水,然后再加入一定量的硫酸,产生能使澄清石灰水浑浊的气体,则证明D溶液中含有CO32-.
③E装置的主要作用是冷凝并收集乙醚.
(2)测定乙烯
反应结束后,用移液管移取C中溶液20mL(不考虑溶液体积变化)于锥形瓶中,先加入约2mL稀硫酸酸化.再用0.1000mol/L的Na2C2O4溶液滴定未反应完的KMnO4.
已知:C2H4$→_{H+}^{KMnO_{4}}$CO2+H2O;C2O42- $→_{H+}^{KMnO_{4}}$CO2+H2O;MnO4-→Mn2+
④以下情况使得测定乙烯的量偏高的是CD
A.在用蒸馏水清洗碱式滴定管后,直接装Na2C2O4标准液
B.锥形瓶清洗干净后残有大量水珠
C.滴定前,滴定管内无气泡,滴定后有气泡
D.读数时,滴定前平视,滴定后俯视
⑤油定终点的现象为溶液由粉红色变成无色,且半分钟内不变色.
⑥已知用去Na2C2O4溶液20.00mL,则乙醇转化成乙烯的转化率为2.94%.
11.化学与生产、生活、社会密切相关,下列有关说法中正确的是( )
| A. | 用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用 | |
| B. | 古有“青蒿一握,以水二升渍,绞取汁”,今用乙醚从黄花蒿中提取青蒿素是利用氧化还原反应原理 | |
| C. | 面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物合物,也属于离子化合物,其阴阳离子冷数比为2:l,过氧化苯甲酞属于有机物 | |
| D. | 二氧化硫有毒,产禁将其添加到任何食品和饮料中 |