题目内容
16.铈、铬、钛、镍不是中学阶段常见的金属元素,但在工业生产中有着重要作用.(1)自然界中Cr主要以+3价和+6价(Cr2O7-)存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬.写出过程中的离子方程式:Cr2O72-+3SO32-+8H+═2Cr3++3SO42-+4H2O.
(2)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是4Na+TiCl4$\frac{\underline{\;550℃\;}}{\;}$Ti+4NaCl.
(3)NiSO4•xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如图:
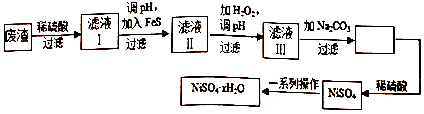
①对滤液Ⅱ先加H2O2再调pH,调pH的目的是除去Fe3+.
②滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是增大NiSO4浓度,有利于蒸发结晶.
③为测定NiSO4•xH2O晶体中x的值,称取26.3g晶体加热至完全失去结晶水,剩余固体15.5g,计算x的值等于6.
分析 (1)用亚硫酸钠将其还原为+3价的铬,说明发生氧化还原反应,亚硫酸钠被氧化;
(2)工业上在550℃时用钠与四氯化钛反应可制得钛,同时生成氯化钠;
(3)电镀废渣(除镍外,还含有铜、锌、铁等元素),过滤后在滤液中加入FeS,生成CuS、ZnS,可除去Cu2+、Zn2+等杂质,对滤液Ⅱ先加W,应为过氧化氢,可氧化Fe2+生成Fe3+,有利于水解生成氢氧化铁沉淀而除去,过滤后在滤液中加入碳酸钠,可生成NiCO3,过滤后加入硫酸可生成NiSO4,经蒸发、浓缩、冷却结晶可得到硫酸镍晶体,以此解答.
解答 解:(1)用亚硫酸钠将其还原为+3价的铬,说明发生氧化还原反应,亚硫酸钠被氧化,反应的离子方程式为Cr2O72-+3SO32-+8H+═2Cr3++3SO42-+4H2O,
故答案为:Cr2O72-+3SO32-+8H+═2Cr3++3SO42-+4H2O;
(2)工业上在550℃时用钠与四氯化钛反应可制得钛,四氯化钛被钠还原为钛,反应的化学方程式为:4Na+TiCl4$\frac{\underline{\;550℃\;}}{\;}$Ti+4NaCl;
故答案为:4Na+TiCl4$\frac{\underline{\;550℃\;}}{\;}$Ti+4NaCl;
(3)①对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+,然后调pH沉淀Fe3+以除去Fe3+,
故答案为:除去Fe3+;
②滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4,可增大成NiSO4浓度,有利于蒸发结晶,
故答案为:增大NiSO4浓度,有利于蒸发结晶;
③剩余固体15.5g,n(NiSO4)=$\frac{15.5g}{115g/mol}$=0.1mol,n(H2O)=$\frac{26.3g-15.5g}{18g/mol}$=0.6mol,则x=$\frac{0.6}{0.1}$=6,
故答案为:6.
点评 本题考查较为综合,涉及氧化还原反应、盐类的水解、物质的分离提纯等知识,为高频考点,侧重于学生的分析能力和实验能力的考查,为高频考点和常见题型,题目难度中等,注意把握基础知识的积累.

| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4-、Al3+ | |
| B. | pH=2的溶液中可能大量存在Na+、NH4+、SiO32-、CO32- | |
| C. | 含有大量AlO2-的溶液中:K+、HCO3-、Br-、Na+可共存 | |
| D. | 在某钠盐溶液中含有等物质的量的Cl-、I-、AlO2-、CO32-、NO3-、SiO32-中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,最终溶液中无沉淀,阴离子种数减少3种,则原溶液中一定有CO32- |
| A. | (Υ1+Υ2-Υ3)L | B. | (Υ1+Υ2+Υ3)L | C. | (Υ1+Υ2-2Υ3)L | D. | [Υ3-(Υ1+Υ2)]L |
| A. | 前2 min,D的平均反应速率为0.2 mol•L-1•min-1 | |
| B. | 此时,B的平衡转化率是40% | |
| C. | 增大该体系的压强,平衡不移动,化学平衡常数不变 | |
| D. | 增加B,平衡向右移动,B的平衡转化率增大 |
| A. |  量筒 | B. |  蒸发皿 | C. |  烧瓶 | D. |  分液漏斗 |
| A. | 2 L二氧化碳分解生成2 L一氧化碳和1 L氧气吸收576 kJ热量 | |
| B. | 恒压条件下生成物的总焓大于反应物的总焓 | |
| C. | 在相同条件下,2 mol一氧化碳与1 mol氧气的能量总和大于2 mol二氧化碳的能量 | |
| D. | 一氧化碳的燃烧热是566 kJ/mol |
| A. | 稳定性:HI>HCl | B. | 熔、沸点:HI>HCl | ||
| C. | 同浓度的HI和HCl的酸性:HI>HCl | D. | 还原性:HI>HCl |
| A. | 绿矾的化学式为FeSO4•7H2O | |
| B. | 绿矾分解过程中没有发生电子的转移 | |
| C. | “色赤”物质可能是Fe2O3 | |
| D. | 流出的液体中可能含有硫酸 |