题目内容
4.中和相同体积、相同pH的 NaOH、Ba(OH)2、NH3•H2O三种溶液,所用相同浓度HCl溶液的体积依次分别是V1、V2、V3.则这三者的关系是( )| A. | V1>V2>V3 | B. | V1<V2<V3 | C. | V1=V2>V3 | D. | V1=V2<V3 |
分析 pH相同时溶液中氢氧根离子浓度相同,氢氧化钠和氢氧化钡为强电解质,则两溶液中氢氧根离子浓度相等,而一水合氨为弱碱,在溶液中部分电离,则一水合氨的浓度最大,中和时消耗盐酸的体积最大,据此进行解答.
解答 解:中和相同体积、相同pH的 NaOH、Ba(OH)2、NH3•H2O三种溶液,NaOH、Ba(OH)2为强电解质,两溶液中氢氧根离子浓度相同,则用盐酸中和时消耗盐酸的体积相等,即V1=V2;
NH3•H2O为弱电解质,只能部分电离出氢氧根离子,则NH3•H2O的浓度最大,用盐酸中和时消耗盐酸体积最大,
所以消耗相同浓度HCl溶液的体积关系为:V1=V2<V3,
故选D.
点评 本题考查了溶液pH的有关计算,题目难度不大,明确弱电解质的电离特点为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
4.下列说法中不正确的是( )
| A. | 液化石油气、汽油、柴油和润滑油的主要成分都是碳氢化合物 | |
| B. | 乙烯、氯乙烯和聚氯乙烯都能因发生加成反应而使溴水褪色 | |
| C. | 用溴水既可以鉴别甲烷和乙烯.也可以除去甲烷中的乙烯 | |
| D. | 可以通过灼烧时的特殊气味来鉴别蛋自质 |
9.对于反应A(s)+3B(g)?2C(g)+2D(g),改变下列条件会使反应速率增大的是( )
| A. | 添加A物质 | B. | 升高体系温度 | C. | 及时分离出C物质 | D. | 减少B物质 |
16.共价键、离子键都是构成物质微粒间的不同相互作用,不同时含有上述两种相互作用是( )
| A. | CO2 | B. | NaOH | C. | Na2O2 | D. | NH4Cl |
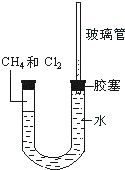 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:1)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.
如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:1)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.  ;
; ;
;