题目内容
19.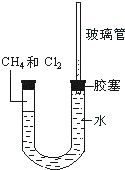 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:1)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.
如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:1)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间. (1)假设甲烷与氯气恰好完全反应,且只产生一种有机物,请写出化学方程式:
CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl
(2)根据(1)的假设,推测反应一段时间后,U型管右端的玻璃管中水柱变化情况
(升高、降低或不变)及变化的主要原因:甲烷和氯气反应生成的氯化氢极易溶于水,全部溶于水,使容器内压强变小,右端的玻璃管中水柱降低.
分析 (1)甲烷与氯气反应充分,甲烷中的H完全被取代,只产生四氯化碳;
(2)甲烷和氯气反应后容器内压强变小,右端的玻璃管中水柱降低.
解答 解:(1)甲烷中的氢原子可以被氯原子取代,甲烷与氯气反应充分,且只产生一种有机物即四氯化碳,反应的化学方程式为CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl,
故答案为:CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl;
(2)甲烷和氯气反应生成的四氯化碳是油状的液体,氯化氢是气体,氯化氢极易溶于水,使容器内压强变小,右端的玻璃管中水柱降低,
故答案为:甲烷和氯气反应生成的氯化氢极易溶于水,全部溶于水,使容器内压强变小,右端的玻璃管中水柱降低.
点评 本题考查甲烷和氯气的化学反应原理实验,为高频考点,把握甲烷的取代反应及取代产物的性质为解答的关键,侧重分析及实验能力的考查,题目难度不大.

练习册系列答案
相关题目
19.下列溶液中微粒浓度关系正确的是( )
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,离子浓度是c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | pH=5的NH4Cl溶液与pH=5的硫酸中,水电离的c(H+)相同 | |
| C. | 将0.2 mol•L-1 CH3COOH溶液和0.1 mol•L-1NaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) | |
| D. | pH=9的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
20.0.1mol Na2CO3•10H2O溶于180g水中,溶液中Na+和H2O个数之比约为( )
| A. | 1:25 | B. | 1:55 | C. | 1:5 | D. | 1:100 |
14.世界上没有真正的垃圾,只有放错了位置的资源!在化学家看来,废物中的原子都可以转化为有用的新物质,关键是找到合适的转化条件.据此垃圾应尽可能的回收,如图四个选项中是垃圾回收标志的是( )
| A. |  | B. |  | C. |  | D. |  |
4.中和相同体积、相同pH的 NaOH、Ba(OH)2、NH3•H2O三种溶液,所用相同浓度HCl溶液的体积依次分别是V1、V2、V3.则这三者的关系是( )
| A. | V1>V2>V3 | B. | V1<V2<V3 | C. | V1=V2>V3 | D. | V1=V2<V3 |
11.下列说法中不正确的是( )
| A. | 门捷列夫的突出贡献是发现元素周期律 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| D. | 在周期表中,在金属与非金属的分界线附近寻找半导体材料 |
9.往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸,溶液的颜色变化应该是( )
| A. | 颜色没有改变 | B. | 颜色变浅 | C. | 变棕黄色 | D. | 颜色逐渐加深 |