题目内容
9.下列属于氧化还原反应的是( )| A. | 2KI+Cl2═2KCl+I2 | B. | CaCO3═CaO+CO2↑ | ||
| C. | SO3+H2O═H2SO4 | D. | MgCl2+2NaOH═Mg(OH)2↓+NaCl |
分析 氧化还原反应的特征是元素化合价的升降,可根据元素化合价的变化解答该题.
解答 解:A.2KI+Cl2═2KCl+I2中,碘和氯元素化合价发生变化,属于氧化还原反应,故A正确;
B.CaCO3═CaO+CO2↑为分解反应,元素化合价没有发生变化,不属于氧化还原反应,故B错误;
C.SO3+H2O═H2SO4,没有元素化合价发生变化,不属于氧化还原反应,故C错误;
D.MgCl2+2NaOH═Mg(OH)2↓+NaCl为复分解反应,元素化合价没有发生变化,不属于氧化还原反应,故D错误.
故选A.
点评 本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
19.在分子 中,在同一平面内的碳原子最少应有( )
中,在同一平面内的碳原子最少应有( )
 中,在同一平面内的碳原子最少应有( )
中,在同一平面内的碳原子最少应有( )| A. | 7个 | B. | 8个 | C. | 9个 | D. | 14个 |
20.下列电解质在溶解或熔化时,没有电离出Cl-的是( )
| A. | 盐酸 | B. | 熔化的氯化钠 | C. | KClO3溶液 | D. | NaCl溶液 |
17.有A、B、C、D四种金属,将A与B用导线联结起来,浸入电解质溶液中,B不易腐蚀.将A、D分别投入等物质的量浓度盐酸中,D比A反应剧烈.将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
| A. | A>D>B>C | B. | D>A>B>C | C. | D>A>C>B | D. | C>B>A>D |
4.如图,反应2X(g)+Y(g)?2Z(g)△H<0,下列分析不正确的是( )
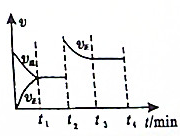

| A. | t2可能是升高温度 | |
| B. | t1时刻Y的体积分数可能比t3时刻Y的体积分数小 | |
| C. | t1时刻X的浓度可能比t3时刻X的浓度大 | |
| D. | t1时的平衡是从逆反应方向建立 |
14.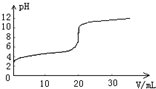 常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )
常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )
 常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )
常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )| A. | 在反应过程中始终,c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | pH=4时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | pH=6时,c(CH3COO-)+c(CH3COOH)=0.1000 mol•L-1 | |
| D. | pH=7时,消耗NaOH溶液的体积小于20.00mL |
1.下列物质性质的比较,不正确的是( )
| A. | 稳定性:H2O>NH3 | B. | 碱性:NaOH>Al(OH)3 | ||
| C. | 氧化性:F2>Cl2 | D. | 酸性:H2SO4>HClO4 |
18.对Na、Mg、Al的有关性质的叙述正确的是( )
| A. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | B. | 原子半径:Na<Mg<Al | ||
| C. | 金属性:Na<Mg<Al | D. | 单质的还原性:Al>Mg>Na |
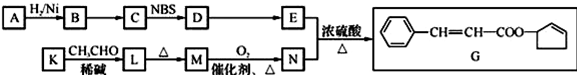
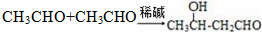
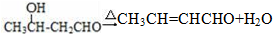
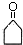 .
.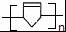 .
.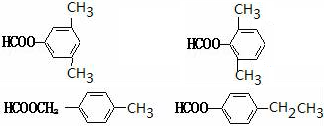 任意2种.
任意2种.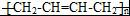 ).请设计合成路线(其他无机原料任选)并用如下方式表示:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物HOCH2CH2CH2CH3$→_{△}^{浓硫酸}$CH2=CHCH2CH3$\stackrel{NBS}{→}$CH2=CHCHBrCH3$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{催化剂}{→}$
).请设计合成路线(其他无机原料任选)并用如下方式表示:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物HOCH2CH2CH2CH3$→_{△}^{浓硫酸}$CH2=CHCH2CH3$\stackrel{NBS}{→}$CH2=CHCHBrCH3$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{催化剂}{→}$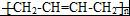 .
.