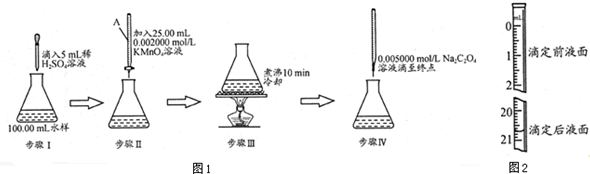
题目内容
14.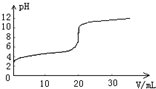 常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )
常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )| A. | 在反应过程中始终,c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | pH=4时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | pH=6时,c(CH3COO-)+c(CH3COOH)=0.1000 mol•L-1 | |
| D. | pH=7时,消耗NaOH溶液的体积小于20.00mL |
分析 A.反应后的溶液一定满足电荷守恒,根据电荷守恒分析;
B.pH=4时,溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒判断;
C.pH=6时,由于加入了氢氧化钠溶液,溶液体积增大,则c(CH3COO-)+c(CH3COOH)<0.1000 mol•L-1;
D.如果消耗NaOH溶液的体积20.00mL,两者恰好完全反应生成醋酸钠,溶液呈碱性,若为中性,则加入的氢氧化钠溶液体积小于20.00mL.
解答 解:A.在反应过程中,一定满足电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故A正确;
B.pH=4的溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒可知:c(CH3COO-)>c(Na+),则溶液中离子浓度的大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C.pH=6时,溶液体积大于20mL,则此时的溶液中c(CH3COO-)+c(CH3COOH)<0.1000 mol•L-1,故C错误;
D.如果消耗NaOH溶液的体积20.00mL,两者恰好完全反应生成醋酸钠,溶液水解呈碱性,若使溶液呈中性,则消耗NaOH溶液的体积小于20.00mL,故D正确;
故选C.
点评 本题考查酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确各点对应溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
4.下列物质中.pH最小的是( )
| A. | 食盐水 | B. | 食醋 | C. | 石灰水 | D. | 纯净水 |
2.下列物质中,能发生取代反应的是( )
| A. | 乙烯 | B. | 甲烷 | C. | 乙炔 | D. | 乙醛 |
9.下列属于氧化还原反应的是( )
| A. | 2KI+Cl2═2KCl+I2 | B. | CaCO3═CaO+CO2↑ | ||
| C. | SO3+H2O═H2SO4 | D. | MgCl2+2NaOH═Mg(OH)2↓+NaCl |
19.下列物质中既含有离子键又含有共价键的化合物是( )
| A. | NaCl | B. | H2O | C. | KOH | D. | CH3Cl |
6.短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )
| A. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| B. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| C. | Y的气态简单氢化物的热稳定性比W的强 | |
| D. | X的最高价氧化物对应的水化物的酸性比W的弱 |
3.下列离子方程式书写正确的是( )
| A. | 少量碳酸氢铵溶液与足量烧碱溶液混合加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 铜片与稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 氨水与稀醋酸反应:OH-+H+═H2O | |
| D. | 铁片与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
15.下列有机化合物中,属于醇的有( )
| A. | CH3CH3 | B. | CH2=CHCl | C. | CH3CH2OH | D. | CH3COOCH2CH3 |