题目内容
18.对Na、Mg、Al的有关性质的叙述正确的是( )| A. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | B. | 原子半径:Na<Mg<Al | ||
| C. | 金属性:Na<Mg<Al | D. | 单质的还原性:Al>Mg>Na |
分析 A.元素的金属性越强,其最高价氧化物的水化物碱性越强;
B.同一周期元素,原子半径随着原子序数增大而减小;
C.同一周期元素,元素的金属性随着原子序数增大而减弱;
D.元素的金属性越强,其单质的还原性越强.
解答 解:A.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性Na>Mg>Al,则碱性:NaOH>Mg(OH)2>Al(OH)3,故A正确;
B.同一周期元素,原子半径随着原子序数增大而减小,原子序数Al>Mg>Na,则原子半径Na>Mg>Al,故B错误;
C.同一周期元素,元素的金属性随着原子序数增大而减弱,原子序数Al>Mg>Na,金属性Na>Mg>Al,故C错误;
D.元素的金属性越强,其单质的还原性越强,金属性Na>Mg>Al,则单质的还原性Na>Mg>Al,故D错误;
故选A.
点评 本题考查元素周期律,为高频考点,明确同一周期原子结构原子性质递变规律是解本题关键,知道金属性非金属性强弱判断方法,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列实验所对应的离子方程式正确的是( )
| A. | 氢氧化铁与氢碘酸反应:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| C. | FeBr2溶液中通入足量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2++4Cl- | |
| D. | 向FeCl2溶液中加入少量K3[Fe(CN)6]溶液:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ |
9.下列属于氧化还原反应的是( )
| A. | 2KI+Cl2═2KCl+I2 | B. | CaCO3═CaO+CO2↑ | ||
| C. | SO3+H2O═H2SO4 | D. | MgCl2+2NaOH═Mg(OH)2↓+NaCl |
6.短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )
| A. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| B. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| C. | Y的气态简单氢化物的热稳定性比W的强 | |
| D. | X的最高价氧化物对应的水化物的酸性比W的弱 |
13.下列做法科学的是( )
| A. | 将废电池深埋 | B. | 大量使用化肥 | ||
| C. | 开发太阳能、风能和氢能 | D. | 大量开发利用可燃冰 |
3.下列离子方程式书写正确的是( )
| A. | 少量碳酸氢铵溶液与足量烧碱溶液混合加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 铜片与稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 氨水与稀醋酸反应:OH-+H+═H2O | |
| D. | 铁片与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
10.某溶液既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe,在该溶液中可以大量共存的离子组是( )
| A. | K+、Na+、HCO3-、NO3- | B. | Na+、SO42-、Cl-、S2- | ||
| C. | NH4+、Mg2+、SO42-、NO3- | D. | H+、K+、Cl-、Na+ |
7.电解在工业生产中有广泛的应用,关于如图所示的电解示意图,下列说法不正确的是( )

| A. | 若为电解饱和食盐水的装置,则a,b上均产生气体 | |
| B. | 若为工业冶炼铝的装置,则用熔融氯化铝作电解液 | |
| C. | 若为工业制钠的装置,则钠在a上生成 | |
| D. | 若利用该装置回收氯化铜溶液中的铜,则a不能是铜 |
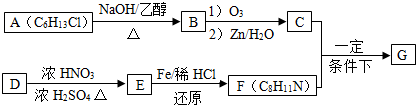
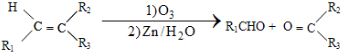
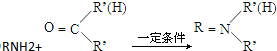
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$  +H2O;
+H2O; ;
; ,(写出其中的一种的结构简式).
,(写出其中的一种的结构简式).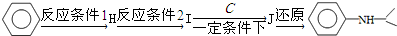
 .
.