题目内容
1.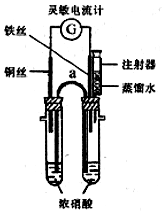 某化学课外活动小组的同学利用原电池原理探究一定温度下(实验时实际的环境温度)使铁钝化的硝酸的最低浓度.
某化学课外活动小组的同学利用原电池原理探究一定温度下(实验时实际的环境温度)使铁钝化的硝酸的最低浓度.实验步骤如下:
①向两支具支试管中分别加入浓硝酸5.0mL(质量分数为65%,密度为1.4g/mL).按图组装好实验装置.
②将铜丝和铁丝同时插入浓硝酸中,观察到灵敏电流计指针先指向铜丝,但又迅速反转(只需1-2s)指向铁丝一端.
③用盛有5.0mL蒸馏水的注射器向具支试管内加水,并注视电流计的指针偏转方向.在指针恰好发生反转又指向铜丝时停止实验,记录此时已注入的水的体积.
重复三次实验获得的数据如下:
| 实验次数 | 实验温度(℃) | 注入水的体积(mL) |
| 1 | 17.2 | 2.4 |
| 2 | T1 | 2.5 |
| 3 | T2 | 2.3 |
(1)在该装置中仪器a因其作用而称为盐桥;指针指向铁丝时,铁丝为正极(填“正”或“负”)
(2)65%的硝酸的物质的量浓度是14.4mol/L;在未注水前正极的电极反应式为NO3-+e-+2H+=NO2↑+H2O.
(3)T1=T2(填“>”、“<”或“=”)
(4)在本实验温度下,使铁钝化的硝酸最低浓度为48%;利用本实验数据判断,若以45%的硝酸进行实验(不再注水),则电流表的指针应指向电极(填“铁”或“铜”)
(5)该实验装置上的不足是缺少尾气处理装置,改进方法是应在两侧支管口处均连接导管,将产生的气体导入盛有氢氧化钠溶液的烧杯中.
分析 (1)在该装置中仪器a因其作用而称为构成闭合路;铁在浓硝酸中发生钝化,所以铜是正极;
(2)根据c=$\frac{1000ρw}{M}$进行计算;正极是硝酸根离子发生还原反应;
(3)温度相同条件下加入水探究一定温度下(实验时实际的环境温度)使铁钝化的硝酸的最低浓度;
(4)重复三次实验平均加水量=$\frac{2.3+2.5+2.4}{3}$ml=2.4ml,溶质守恒计算,将铜丝和铁丝同时插入浓硝酸中,观察到灵敏电流计指针先指向铜丝,但又迅速反转(只需1-2s)指向铁丝一端,是开始贴发生钝化后做正极,铜做负极;
(5)反应过程中所生产的氮的氧化物是有毒气体会污染空气;
解答 解:(1)在该装置中仪器a因其作用而称为盐桥;铁在浓硝酸中发生钝化,所以铜是正极,所以铁是正极,故答案为:盐桥;正;
(2)根据c=$\frac{1000ρw}{M}$=$\frac{1000×1.4×65%}{63}$=14.4mol/L;正极是硝酸根离子发生还原反应,电极反应式为:NO3-+e-+2H+=NO2↑+H2O,
故答案为:14.4mol/L;NO3-+e-+2H+=NO2↑+H2O;
(3)温度相同条件下加入水探究一定温度下(实验时实际的环境温度)使铁钝化的硝酸的最低浓度,改变加入水的量体坛就钝化浓度,所以温度不变,故T1=T2 ,
故答案为:=;
(4)重复三次实验平均加水量=$\frac{2.3+2.5+2.4}{3}$ml=2.4ml,使铁钝化的硝酸最低浓度=$\frac{5.0×1.4×65%}{5.0×1.4+2.4}$×100%=48%,利用本实验数据判断,若以45%的硝酸进行实验(不再注水),铁不发生钝化,铁做负极,则电流表的指针应指向电极铜电极,
故答案为:48;铜;
(5)反应过程中所生产的了氮的氧化物是有毒气体会污染空气,该实验装置的不足之处是没有尾气处理装置,应在两侧支管口处均连接导管,将产生的气体导入盛有氢氧化钠溶液的烧杯中吸收尾气,避免排放到空气中污染环境,
故答案为:缺少尾气处理装置,应在两侧支管口处均连接导管,将产生的气体导入盛有氢氧化钠溶液的烧杯中;
点评 本题考查了原电池原理的分析应用,注意铁在常温下在浓硝酸中的钝化,实验探究不同条件下钝化影响因素的分析判断,题目难度中等.

 中考解读考点精练系列答案
中考解读考点精练系列答案| A. | 溶液中Na+浓度增大,有O2放出 | B. | 溶液中OH-总数不变,有O2放出 | ||
| C. | 溶液的pH增大,有O2放出 | D. | 溶液中Na+总数减少,有O2放出 |
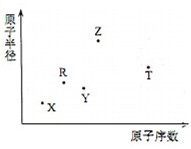 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T.下列推断错误的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T.下列推断错误的是( )| A. | 形成的简单离子半径的大小顺序为T>Y>Z | |
| B. | Z2Y、Z2Y2所含有的化学键类型相同 | |
| C. | 0.005mol•L-1T的最高价氧化物对应水化物的水溶液pH等于2 | |
| D. | Z2T的水溶液显碱性,对水的电离有促进作用 |
 紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取.
紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取.| 乙醇 | 四氯化碳 | 碘(晶体) | |
| 密度/g•cm-3 | 0.7893 | 1.595 | 4.94 |
| 沸点/℃ | 78.5 | 76.8 | 184.35 |
A.烧杯 B.表面皿 C.蒸发皿 D.坩埚
E.试管 F.酒精灯 G.三脚架 H.泥三角
(2)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,其目的是将溶液中的I-转化为I2.
(3)过滤 (填一种基本操作的名称),弃去残渣,将所得的产物转入分液漏斗 (填一种玻璃仪器的名称)中,加入少量的四氯化碳 (填本题表格中一种最佳化学试剂的名称),振荡、静置,首先将紫色下层液体分离出来.
(4)将如图装置图中缺少的必要仪器补画出来以最终获得固态的单质碘(不考虑碘的进一步提纯):
 .
. 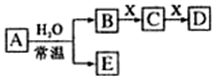 A、B、C、D、E、X均为中学化学常见物质,其中A、B、C、D、E是由短周期元素组成的无机物,它们存在如图转化关系(部分生成物和反应条件略去).请回答下列问题:
A、B、C、D、E、X均为中学化学常见物质,其中A、B、C、D、E是由短周期元素组成的无机物,它们存在如图转化关系(部分生成物和反应条件略去).请回答下列问题: ; B与X反应生成C的离子方程式2OH-+CO2=CO32-+H2O;
; B与X反应生成C的离子方程式2OH-+CO2=CO32-+H2O;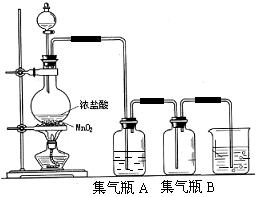 实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O
实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O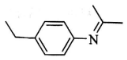 )有广泛应用.合成G的一种路径如图.1H-NMR谱显示C结构中只有一种环境的氢,且不能发生银镜反应,D的组成为C8H10.
)有广泛应用.合成G的一种路径如图.1H-NMR谱显示C结构中只有一种环境的氢,且不能发生银镜反应,D的组成为C8H10.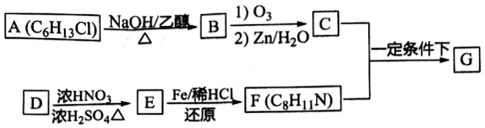
 $→_{②Zn/H_{2}O}^{①O_{3}}$R1CHO+
$→_{②Zn/H_{2}O}^{①O_{3}}$R1CHO+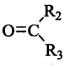
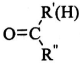 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +H2O
+H2O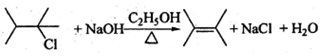 .
. .
.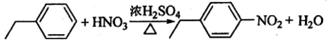 .
.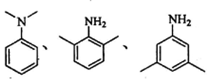 .
.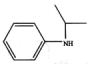 )的合成路线(流程图表示,无机试剂任选)
)的合成路线(流程图表示,无机试剂任选)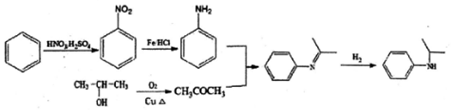 .
.