题目内容
16. A、B、C、D、E、X均为中学化学常见物质,其中A、B、C、D、E是由短周期元素组成的无机物,它们存在如图转化关系(部分生成物和反应条件略去).请回答下列问题:
A、B、C、D、E、X均为中学化学常见物质,其中A、B、C、D、E是由短周期元素组成的无机物,它们存在如图转化关系(部分生成物和反应条件略去).请回答下列问题:I.若A为单质
(1)当E为单质,X为氧化物,且X是一种温室效应气体时,写出X的电子式
 ; B与X反应生成C的离子方程式2OH-+CO2=CO32-+H2O;
; B与X反应生成C的离子方程式2OH-+CO2=CO32-+H2O;(2)当B、E均为化合物,且D为白色胶状沉淀时,写出E的一种用途漂白剂或杀菌消毒;B与X反应生成C的离子方程式AlO2-+4H+=Al3++2H2O;
II.若A为化合物
(3)当A与H2O反应为氧化还原反应时,且氧化剂与还原剂物质的量之比为1:2,X为一种金属,则D与氢氧化钠溶液反应的实验现象是生成白色沉淀迅速转化为灰绿色最后变为红褐色
(4)当A与H2O的反应为非氧化还原反应时,且A中阴、阳离子分别为18电子与10电子粒子,A中的阳离子是其所在周期中简单离子半径最小的.则A与H2O反应的化学方程式为:Al2S3+6H2O=2Al(OH)3+3H2S↑.
分析 I.(1)X是一种温室效应气体,应为CO2,可知A为Na,B为NaOH,由转化关系可知C为Na2CO3,D为NaHCO3,E为H2;
(2)D为白色胶状沉淀,应为Al(OH)3,A可为Cl2,B为HCl,E为HClO等,X为NaAlO2,C为AlCl3;
II.(3)当A与H2O反应为氧化还原反应时,且氧化剂与还原剂物质的量之比为1:2,可NO2为与水的反应,A为NO2,E为NO,B为HNO3,C为Fe(NO3)3,D为Fe(NO3)2;
(4)A中的阳离子是其所在周期中简单离子半径最小的,阳离子应为Al,A与H2O的反应为非氧化还原反应时,且A中阴、阳离子分别为18电子与10电子粒子,则A为Al2S3,与水反应生成氢氧化铝和硫化氢.
解答 解:(1)X为二氧化碳,电子式为 ,B为NaOH,C为Na2CO3,B与X反应生成C的离子方程式为2OH-+CO2=CO32-+H2O,
,B为NaOH,C为Na2CO3,B与X反应生成C的离子方程式为2OH-+CO2=CO32-+H2O,
故答案为: ;2OH-+CO2=CO32-+H2O;
;2OH-+CO2=CO32-+H2O;
(2)E为HClO,具有强氧化性,可用于漂白剂或杀菌消毒,B为HCl,X为NaAlO2,C为AlCl3,B与X反应生成C的离子方程式为AlO2-+4H+=Al3++2H2O,
故答案为:漂白剂或杀菌消毒;AlO2-+4H+=Al3++2H2O;
(3)D为Fe(NO3)2,加入氢氧化钠生成不稳定的氢氧化亚铁,易被氧化生成氢氧化铁,现象是生成白色沉淀迅速转化为灰绿色最后变为红褐色,
故答案为:生成白色沉淀迅速转化为灰绿色最后变为红褐色;
(4)A为Al2S3,与水反应生成氢氧化铝和硫化氢,方程式为Al2S3+6H2O=2Al(OH)3+3H2S↑,故答案为:Al2S3+6H2O=2Al(OH)3+3H2S↑.
点评 本题考查无机物的推断,是高考中的常见题型,试题综合性强,难度较大,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生分析问题、以及灵活运用基础知识解决实际问题的能力.做好本题的关键之处在于把握好常见物质的性质以及有关转化,并能结合题意具体问题、具体分析即可.

 阅读快车系列答案
阅读快车系列答案| A. | 甘油用作护肤保湿剂 | |
| B. | 高锰酸钾溶液用于水果保鲜 | |
| C. | 铁粉用作食品袋中的脱氧剂 | |
| D. | 浓盐酸用于检验输送氨气管道是否漏气 |
 某化学课外活动小组的同学利用原电池原理探究一定温度下(实验时实际的环境温度)使铁钝化的硝酸的最低浓度.
某化学课外活动小组的同学利用原电池原理探究一定温度下(实验时实际的环境温度)使铁钝化的硝酸的最低浓度.实验步骤如下:
①向两支具支试管中分别加入浓硝酸5.0mL(质量分数为65%,密度为1.4g/mL).按图组装好实验装置.
②将铜丝和铁丝同时插入浓硝酸中,观察到灵敏电流计指针先指向铜丝,但又迅速反转(只需1-2s)指向铁丝一端.
③用盛有5.0mL蒸馏水的注射器向具支试管内加水,并注视电流计的指针偏转方向.在指针恰好发生反转又指向铜丝时停止实验,记录此时已注入的水的体积.
重复三次实验获得的数据如下:
| 实验次数 | 实验温度(℃) | 注入水的体积(mL) |
| 1 | 17.2 | 2.4 |
| 2 | T1 | 2.5 |
| 3 | T2 | 2.3 |
(1)在该装置中仪器a因其作用而称为盐桥;指针指向铁丝时,铁丝为正极(填“正”或“负”)
(2)65%的硝酸的物质的量浓度是14.4mol/L;在未注水前正极的电极反应式为NO3-+e-+2H+=NO2↑+H2O.
(3)T1=T2(填“>”、“<”或“=”)
(4)在本实验温度下,使铁钝化的硝酸最低浓度为48%;利用本实验数据判断,若以45%的硝酸进行实验(不再注水),则电流表的指针应指向电极(填“铁”或“铜”)
(5)该实验装置上的不足是缺少尾气处理装置,改进方法是应在两侧支管口处均连接导管,将产生的气体导入盛有氢氧化钠溶液的烧杯中.
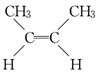
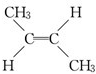
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
 将无水乙醇、冰醋酸、浓硫酸放入烧瓶中,并加入沸石,加热一段时后,再更换装置可蒸馏出乙酸乙酯.
将无水乙醇、冰醋酸、浓硫酸放入烧瓶中,并加入沸石,加热一段时后,再更换装置可蒸馏出乙酸乙酯.


 、
、 .
.