题目内容
16.用20mL 18.4mol/L浓H2SO4和铜共热一段时间后,使反应混合物冷却,滤去多余的铜,将滤液加水定容到100mL,测得SO42-离子浓度为3.18mol/L,则100mL溶液中CuSO4的物质的量浓度为0.5 mol•L-1.分析 由Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O可知,生成的CuSO4的物质的量=生成SO2的物质的量=溶液中SO42-减少的物质的量,据此计算溶液中n(CuSO4),根据c=$\frac{n}{V}$计算溶液中CuSO4 的物质的量浓度.
解答 解:根据Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O可知,生成的CuSO4的物质的量=生成SO2的物质的量=溶液中SO42-减少的物质的量,
则反应后溶液中硫酸铜的物质的量为:n(CuSO4)=0.02L×18.4 mol•L-1-0.1L×3.18 mol•L-1=0.05mol,
所以100ml溶液中硫酸铜的浓度为:c(CuSO4)=$\frac{0.05mol}{0.1L}$═0.5 mol•L-1,
故答案为:0.5 mol•L-1.
点评 本题考查化学方程式有关计算,题目难度中等,根据反应方程式得出生成的CuSO4的物质的量=生成SO2的物质的量=溶液中SO42-减少的物质的量的关系为解答关键,注意掌握守恒思想在化学计算中的应用方法.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
4.如图所示装置中a、b为惰性电极,通电后,Cu电极上有气体产生,甲装置中溶液变蓝色.则下列说法正确的是( )
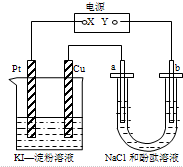

| A. | X可以是电源的负极,也可以是电源的正极 | |
| B. | 甲装置的电池反应是:2Cu2++4I-=2CuI↓+I2 | |
| C. | 乙装置a电极周围溶液变红色,pH变大 | |
| D. | 乙装置中Na+向b电极迁移 |
5. 元素周期表是学习化学的重要工具,右图是元素周期表中的一格,以下获取的信息错误的是( )
元素周期表是学习化学的重要工具,右图是元素周期表中的一格,以下获取的信息错误的是( )
 元素周期表是学习化学的重要工具,右图是元素周期表中的一格,以下获取的信息错误的是( )
元素周期表是学习化学的重要工具,右图是元素周期表中的一格,以下获取的信息错误的是( )| A. | 该元素的原子序数是53 | B. | 该元素属于金属元素 | ||
| C. | 该元素的原子核外有53个电子 | D. | 该元素的相对原子质量为126.9 |
12.将氯气通入含有大量下列离子的各组溶液中,无现象发生的是( )
| A. | Na+ H+ SO42- | B. | H+ Ag+ NO3- | C. | K+ HCO3-Cl- | D. | Na+ NO3- Fe2+ |
9.下图微粒的结构示意图,正确的是( )
| A. |  Mg2+ Mg2+ | B. |  Cl Cl | C. |  Ar Ar | D. | K  |