题目内容
7.碱式碳酸铜是一种用途广泛的化工原料,其化学式一般可表示为Cu(OH)2•xCuCO3.某实验小组设计如下几个实验方案,测得碱式碳酸铜的组成,完成下列填空.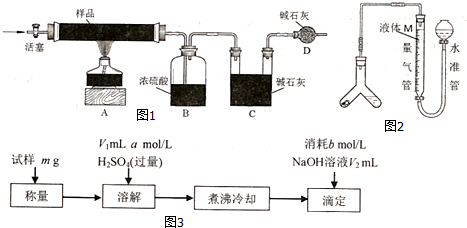
【方案一】用如图1实验装置进行实验(夹持仪器省略),先通一段时间氮气,然后加热,加热完毕,再通一段时间氮气.
(1)加热完毕再通一段时间氮气的作用是将反应生成的水蒸气和二氧化碳全部赶至装置B、C中被完全吸收.
(2)图1中装置D的作用是防止装置C吸收空气中的水蒸气和二氧化碳,影响测定结果.
(3)若实验取14.200g样品,B装置增重0.900g,C装置增重3.300g,则x=1.5.
【方案二】用途2装置测定碱式碳酸铜与足量稀硫酸反应生成CO2的体积.
(4)为了减小实验误差,量气管中液体M的选择原则是二氧化碳在M溶液中溶解度要小.
(5)通过实验,测得该式样中x值偏低,产生这种现象的原因可能是a.
a.CO2气体中含有水蒸气 b.测定气体体积时未冷却至室温
c.Y型管中留有反应生成的气体 d.测定气体体积时水准管的液面高于量气管的液面
【方案三】该小组同学又用如图3方案测定碱式碳酸铜的组成.
(6)加热煮沸的目的是将生成的二氧化碳全部赶出,避免影响滴定结果.
(7)若滴定时NaOH加入过量,则x值偏大(填“偏大”、“偏小”或“不变”).
分析 方案一:加热样品分解为CuO、二氧化碳与水,根据B中浓硫酸溶液增重测定生成水的质量,根据C中碱石灰增重测定生成二氧化碳的质量,D中碱石灰吸收空气中二氧化碳与水蒸气,防止加进入C中,根据硬质玻璃管中最终剩余固体为CuO,计算各自物质的量,根据原子守恒可以计算氢氧化铜、碳酸铜的物质的量,进而确定化学式;
方案二:(4)利用排M液态测定二氧化碳的体积,则二氧化碳在M溶液中溶解性要小;
(5)a.CO2气体中含有水蒸气,测定二氧化碳的体积偏大;
b.测定气体体积时未冷却至室温,冷却后二氧化碳体积较小,则测定二氧化碳体积偏大;
c.Y型管中留有反应生成的气体,同时排出等体积的空气,不影响二氧化碳体积的测量;
d.测定气体体积时水准管的液面高于量气管的液面,二氧化碳的压强比空气大被压缩,测定二氧化碳的体积偏小;
方案三:硫酸与碱式碳酸铜反应生成硫酸铜与二氧化碳,煮沸赶出溶液中溶解的二氧化碳,再用氢氧化钠溶液滴定剩余的硫酸,可以计算参加反应硫酸物质的量,铜离子物质的量与消耗硫酸的物质的量相等,结合碱式碳酸铜的质量,列方程计算氢氧化铜、碳酸铜的物质的量,进而取得化学式,如果在滴定中加入氢氧化钠过量,会生成氢氧化铜沉淀,导致测定剩余硫酸物质的量偏大,消耗硫酸偏小,则沉淀Cu质量偏小,而碳酸铜中Cu的质量分数小于氢氧化铜中Cu的质量分数,则沉淀碳酸铜的含量偏高.
解答 解:方案一:加热样品分解为CuO、二氧化碳与水,根据B中浓硫酸溶液增重测定生成水的质量,根据C中碱石灰增重测定生成二氧化碳的质量,D中碱石灰吸收空气中二氧化碳与水蒸气,防止加进入C中,根据硬质玻璃管中最终剩余固体为CuO,计算各自物质的量,根据原子守恒可以计算氢氧化铜、碳酸铜的物质的量,进而确定化学式.
(1)加热完毕再通一段时间氮气的作用是:将反应生成的水蒸气和二氧化碳全部赶至装置B、C中被完全吸收,
故答案为:将反应生成的水蒸气和二氧化碳全部赶至装置B、C中被完全吸收;
(2)图1中装置D的作用是:防止装置C吸收空气中的水蒸气和二氧化碳,影响测定结果,
故答案为:防止装置C吸收空气中的水蒸气和二氧化碳,影响测定结果;
(3)B装置增重0.900g,则生成水为$\frac{0.9g}{18g/mol}$=0.05mol
C装置增重3.300g,则生成二氧化碳为$\frac{3.3g}{44g/mol}$=0.075mol,
由原子守恒可知,碱式碳酸铜中氢氧化铜为0.05mol,碳酸铜为0.075mol,则1:x=0.05mol:0.075mol,解得x=1.5,
故答案为:1.5;
方案二:(4)为了减小实验误差,量气管中液体M的选择原则是:二氧化碳在M溶液中溶解度要小,
故答案为:二氧化碳在M溶液中溶解度要小;
(5)a.CO2气体中含有水蒸气,测定二氧化碳的体积偏大,测得该式样中x值偏高,故a不符合;
b.测定气体体积时未冷却至室温,冷却后二氧化碳体积较小,则测定二氧化碳体积偏大,测得该式样中x值偏高,故b不符合;
c.Y型管中留有反应生成的气体,同时排出等体积的空气,不影响二氧化碳体积的测量,故c不符合;
d.测定气体体积时水准管的液面高于量气管的液面,二氧化碳的压强比空气大被压缩,测定二氧化碳的体积偏小,则测得该式样中x值偏低,故d符合,
故选:d;
方案三:硫酸与碱式碳酸铜反应生成硫酸铜与二氧化碳,煮沸赶出溶液中溶解的二氧化碳,再用氢氧化钠溶液滴定剩余的硫酸,可以计算参加反应硫酸物质的量,铜离子物质的量与消耗硫酸的物质的量相等,结合碱式碳酸铜的质量,列方程计算氢氧化铜、碳酸铜的物质的量,进而取得化学式.
(6)用氢氧化钠滴定剩余硫酸时,溶解在溶液中的二氧化碳能与氢氧化钠溶液反应,使测定剩余的硫酸偏大,故加热煮沸的目的:将生成的二氧化碳全部赶出,避免影响滴定结果,
故答案为:将生成的二氧化碳全部赶出,避免影响滴定结果;
(7)如果在滴定中加入氢氧化钠过量,会生成氢氧化铜沉淀,导致测定剩余硫酸物质的量偏大,消耗硫酸偏小,则沉淀Cu质量偏小,而碳酸铜中Cu的质量分数小于氢氧化铜中Cu的质量分数,则沉淀碳酸铜的含量偏大,
故答案为:偏大.
点评 本题考查物质组成测定,属于并列型题目,解题的关键在于理解实验方案的原理,是对学生分析计算能力的综合考查,难度中等.

| A. | A2>B2>C2>D2 | B. | D2>C2>B2>A2 | C. | B2>C2>A2>D2 | D. | C2>A2>B2>D2 |
| A. | CH3CH2COOCH=CH2 | B. | CH3CH2COOCH2CH2CH3 | ||
| C. | CH2=CHCH2COOCH2CH2CH=CH2 | D. | CH3CH2CH2COOCH2CH(CH3)2 |
(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则 N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
A.4.20 B.4.00 C.2.95 D.2.80
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如图1所示:
| 试验编号 | T/℃ | NO初始浓度/10-3mol•L-1 | CO初始浓度/10-3mol•L-1 | 催化剂的比表面积/m2•g1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |

则曲线Ⅱ对应的实验编号为②.
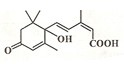 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )| A. | 含有碳碳双键、羟基、羰基、羧基 | B. | 1mol该物质可消耗2molNaOH | ||
| C. | 分子式为C14H20O4 | D. | 1mol该物质可与3molH2加成 |
| A. | CH3-CH2-CH3 | B. | CH2=CHCH2CH3 | C. | CH3C=CCH2CH3 | D. |  |
 .
.