题目内容
12.将氯气通入含有大量下列离子的各组溶液中,无现象发生的是( )| A. | Na+ H+ SO42- | B. | H+ Ag+ NO3- | C. | K+ HCO3-Cl- | D. | Na+ NO3- Fe2+ |
分析 氯气和水反应生成盐酸和次氯酸,溶液呈酸性,含有H+、Cl-、HClO等,以及对应物质的性质解答该题.
解答 解:A.氯水与该组离子都不反应,没有任何现象,故A选;
B.Cl-、Ag+反应生成AgCl沉淀,故B不选;
C.H+、HCO3-反应生成气体,故C不选;
D.酸性条件下,NO3-、Fe2+发生氧化还原反应,故D不选.
故选A.
点评 本题考查氯气的性质,为高频考点,侧重于学生的分析能力的考查,主要把握氯气的性质以及离子反应的特点,明确氯水的成分为解答该题的关键,难度不大.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
18.酯X完全燃烧生成二氧化碳和水的物质的量之比为1:1,X水解可得酸甲和醇乙,醇氧化后可得酸丙,且甲和丙是同分异构体,则X是( )
| A. | CH3CH2COOCH=CH2 | B. | CH3CH2COOCH2CH2CH3 | ||
| C. | CH2=CHCH2COOCH2CH2CH=CH2 | D. | CH3CH2CH2COOCH2CH(CH3)2 |
19.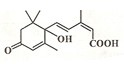 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )| A. | 含有碳碳双键、羟基、羰基、羧基 | B. | 1mol该物质可消耗2molNaOH | ||
| C. | 分子式为C14H20O4 | D. | 1mol该物质可与3molH2加成 |
7.下列离子方程式不 正确的是( )
| A. | NH4HCO3与足量NaOH混合加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | NH3通入稀H2SO4中:NH3+H+═NH4+ | |
| C. | NaOH和NH4Cl稀溶液混合加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 氨水中加入稀盐酸:NH3•H2O+H+═NH4++H2O |
4.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有HClO | |
| D. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
1.下列有机化合物分子中所有的碳原子都处于问一平面的是( )
| A. | CH3-CH2-CH3 | B. | CH2=CHCH2CH3 | C. | CH3C=CCH2CH3 | D. | 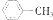 |
2.下列现象或事实正确,反应类型也正确的是( )
| 选项 | 现象或事实 | 反应类型 |
| A | 四氯化碳和苯酚都能使溴水褪色 | 取代反应 |
| B | 甲苯和甲酸都能使酸性高锰酸钾溶液褪色 | 氧化反应 |
| C | 一氯甲烷和乙醇都能制备乙烯 | 消去反应 |
| D | 聚乙烯和聚乙炔都能使溴的四氯化碳溶液褪色 | 加成反应 |
| A. | A | B. | B | C. | C | D. | D |