题目内容
4.如图所示装置中a、b为惰性电极,通电后,Cu电极上有气体产生,甲装置中溶液变蓝色.则下列说法正确的是( )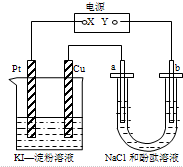
| A. | X可以是电源的负极,也可以是电源的正极 | |
| B. | 甲装置的电池反应是:2Cu2++4I-=2CuI↓+I2 | |
| C. | 乙装置a电极周围溶液变红色,pH变大 | |
| D. | 乙装置中Na+向b电极迁移 |
分析 a、b都是惰性电极,通电一段时间后,Cu电极上有气体产生,所以铜为阴极水电离产生的氢离子放电生成氢气,则a是阳极、b是阴极,所以X是正极、Y是负极,据此分析解答.
解答 解:a、b都是惰性电极,通电一段时间后,Cu电极上有气体产生,所以铜为阴极水电离产生的氢离子放电生成氢气,则a是阳极、b是阴极,所以X是正极、Y是负极,
A、X是电源的正极,故A错误;
B、甲装置铜极是水电离出的氢离子放电,生成氢气,而铜单质本身不放电,故B错误;
C、乙装置b电极是氢离子放电,生成氢气,同时产生氢氧根离子,周围溶液变红色,pH变大,故C错误;
D、乙装置中Na+向阴极b电极迁移,故D正确;
故选D.
点评 本题考查了电解原理,明确各个电极上放电的离子是解本题关键,根据各个电极上发生的反应来分析即可,题目难度不大.

练习册系列答案
相关题目
15.汽车尾气中的主要污染物是NO和CO.为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则 N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
则C2合理的数值为D(填字母标号).
A.4.20 B.4.00 C.2.95 D.2.80
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如图1所示:

则曲线Ⅱ对应的实验编号为②.
(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则 N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
A.4.20 B.4.00 C.2.95 D.2.80
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如图1所示:
| 试验编号 | T/℃ | NO初始浓度/10-3mol•L-1 | CO初始浓度/10-3mol•L-1 | 催化剂的比表面积/m2•g1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |

则曲线Ⅱ对应的实验编号为②.
19.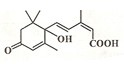 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )| A. | 含有碳碳双键、羟基、羰基、羧基 | B. | 1mol该物质可消耗2molNaOH | ||
| C. | 分子式为C14H20O4 | D. | 1mol该物质可与3molH2加成 |

 .
. .
. .
.