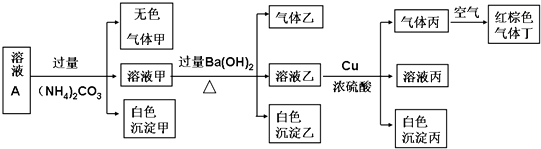
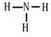题目内容
11.120mL浓度为1mol/L的Na2SO3溶液,恰好与100mL浓度为0.4mol/L的K2Cr2O7溶液完全反应,在还原产物中Cr元素的化合价( )| A. | +3 | B. | +1 | C. | +4 | D. | +2 |
分析 Na2SO3被氧化为Na2SO4,S元素化合价由+4价升高为+6价;K2Cr2O7中Cr元素发生还原反应,令Cr元素在产物中的化合价为a价,根据电子转移守恒计算a的值.
解答 解:令Cr元素在产物中的化合价为a价,根据电子转移守恒,则:
0.12L×1mol/L×(6-4)=0.1L×0.4mol/L×2×(6-a)
解得a=+3
故选A.
点评 本题考查氧化还原反应计算、氧化还原反应概念等,难度中等,表示出得失数目是解题关键,熟练掌握电子转移守恒思想的运用.

练习册系列答案
相关题目
7. BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从 出发合成BHT的方法有如图两种.下列说法错误的是
出发合成BHT的方法有如图两种.下列说法错误的是
(BHT)( )
 BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从 出发合成BHT的方法有如图两种.下列说法错误的是
出发合成BHT的方法有如图两种.下列说法错误的是(BHT)( )
| A. | BHT与 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 | |
| B. | BHT在水中的溶解度小于苯酚 | |
| C. | 两种方法的反应类型都是加成反应 | |
| D. | 从绿色化学角度分析方法一优于方法二 |
20.在托盘天平两端的烧杯中加入同浓度同体积的足量盐酸,向两个烧杯中分别加入1mol两种金属充分反应后,天平依然平衡,则这两种金属是( )
| A. | Mg和Al | B. | Al和Fe | C. | Fe和Cu | D. | Na和Mg |
1.下列反应的离子方程式正确的是( )
| A. | 纯碱溶液中加入苯酚:CO32-+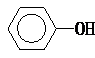 → →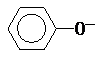 +HCO3- +HCO3- | |
| B. | 小苏打溶液中加醋酸溶液:HCO3-+CH3COOH→CO2↑+CH3COO- | |
| C. | 明矾溶液中加入过量的Ba(OH)2溶液:Al3++4OH-→AlO2-+2H2O | |
| D. | 氯化铵溶于水:NH4++2H2O?H3O++NH3•H2O |